
【题目】NH3的催化氧化是工业制取硝酸的关键步骤之一,该反应的化学方程式为:
4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),△H<0。
4NO(g)+6H2O(g),△H<0。
请回答下列问题:
(1)在恒温恒容下判断该反应达到平衡状态的标志是________(填字母)。
a.NH3和NO浓度相等
b.NO百分含量保持不变
c.容器中气体的压强不变
d.NH3的生成速率与NO的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3平衡转化率的是_____________。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2 c.改变反应的催化剂 d.降低温度
(3)将0.050 mol NH3 (g)和0.060 mol O2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(NO)=0.040 mol/L。计算该条件下反应的NH3的转化率和写出平衡常数K 的表达式(不必写出计算过程)。
①平衡常数的表达式K=________________;
②平衡时,NH3的转化率α(NH3 )=________________。
【答案】 bc bd ①K=![]() 80%
80%
【解析】试题分析:(1)a.平衡时NH3和NO浓度关系与氨气转化率有关,不一定相等,a错误;b.NO百分含量保持不变,说明到达平衡,b正确;c.随反应进行,混合气体总物质的量增加,恒温恒容下容器内压强增大,当容器中气体的压强不变,说明到达平衡,c正确;d.NH3的生成速率与NO的消耗速率均表示逆反应速率,反应始终相等,不能说明到达平衡,NH3的生成速率与NO的生成速率相等,说明到达平衡,d错误,答案选bc;
(2)a.向装置中再充入氮气,压强增大,但物质的浓度不变,平衡不移动,氨气平衡转化率不变,a错误;B.向装置中再充入O2,平衡显正反应方向进行,氨气平衡转化率增大,b正确;c.改变反应的催化剂,不影响平衡移动,氨气平衡转化率不变,c错误;d.正反应为放热反应,降低温度,平衡正向移动,氨气平衡转化率增大,d正确,答案选bd;
(3)①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此根据方程式可知平衡常数表达式K=![]() ;
;
②4NH3(g)+ 5O2 (g)![]() 4NO(g) +6H2O(g)
4NO(g) +6H2O(g)
起始浓度(mol/L) 0.05 0.06 0 0
变化浓度(mol/L) 0.04 0.05 0.04 0.06
平衡浓度(mol/L):0.01 0.01 0.04 0.06
所以氨气的转化率是![]() ×100%=80%。
×100%=80%。


科目:高中化学 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式的是 ( )
A. 实验室用大理石和稀盐酸制取CO2 :2H++CO32- = CO2↑+H2O
B. 硫酸铜与氢氧化钡溶液反应:Ba2++SO42- = BaSO4 ↓
C. Fe(OH)3与盐酸反应:H++ OH- = H2O
D. Fe2O3溶于稀硫酸: 6H++ Fe2O3 = 2 Fe 3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解池的叙述中,不正确的是( )
A.在电解池的阳极发生氧化反应
B.与电源正极相连的是电解池的阴极
C.与电源负极相连的是电解池的阴极
D.电子从电源的负极沿导线流入电解池的阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯原子对O3的分解有催化作用:O3(g)+Cl(g)===ClO(g)+O2(g) ΔH1 ①
ClO(g)+O(g)===Cl(g)+O2(g) ΔH2 ②
该反应的能量变化如图所示,下列叙述中正确的是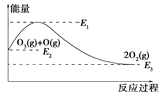
A. 反应O3(g)+O(g)===2O2(g)的ΔH=E1-E2
B. 反应O3(g)+O(g)===2O2(g)的ΔH=E2-E3
C. 反应O3(g)+O(g)===2O2(g)是吸热反应
D. 反应O3(g)+O(g)===2O2(g)的ΔH=ΔH1+ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用元素符号或化学式等化学用语回答下列问题: 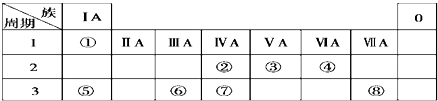
(1)元素①的名称是 .
(2)元素②、⑥、⑦的原子半径由大到小的顺序是(用元素符号表示).
(3)写出元素③的最高价氧化物的化学式: .
(4)用电子式表示出元素⑤与⑧形成化合物的过程: .
(5)元素②的最高正价是 , 它与元素④按照原子个数比为1:2形成的化合物的结构式是 , 该化合物是(离子、共价)化合物.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.碳酸氢钠溶液和盐酸的反应B.Ba(OH)2·8H2O与NH4Cl反应
C.灼热的炭与二氧化碳反应D.甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]() ,某温度下的平衡常数为4,此温度下,在2L的密闭容器中加入amolA,反应到某时刻测得各组分的浓度如下表,则下列说法中正确的是
,某温度下的平衡常数为4,此温度下,在2L的密闭容器中加入amolA,反应到某时刻测得各组分的浓度如下表,则下列说法中正确的是

A. a=1.0
B. 此时刻正反应速率小于逆反应速率
C. 在相同条件下,若起始时加入2amolA,则达到平衡时A的转化率减小
D. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的沸点按由高到低的顺序排列正确的是
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.②④①③ B.④②①③ C.④③②① D.②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
Fe2O3(s)+![]() CO(g)=
CO(g)=![]() Fe3O4(s)+CO2(g) △H=-15.73 kJ·mol-1
Fe3O4(s)+CO2(g) △H=-15.73 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.4 kJ·mol-1
则14g CO气体还原足量FeO固体得到固体Fe和CO2气体时,对应的△H为
A.-218 kJ·mol-1 B.-109 kJ·mol-1
C.+218 kJ·mol-1 D.+109 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com