
| A. | 山西王家岭煤矿3•28透水事故被困工作在井下靠吃木屑、树皮,喝凉水维持生命.木屑、树皮的化学成分主要是纤维素 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 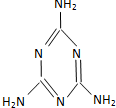 广为人知的奶粉事件中的罪魁祸首为三聚氰胺(结构如图)其摩尔质量为126g | |
| D. | 2010年4月支援青海玉树地震灾区的生活用品中的食醋、纯碱、食盐,其对应的主要化学物质分别属于酸、碱、盐 |
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠固体 | B. | 硫酸铜固体 | C. | 硝酸钾溶液 | D. | 氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态原子第五电子层只有2个电子,则该原子第四电子层的电子数肯定为8或18个 | |
| B. | 核外电子数为奇数的基态原子,其原子轨道中一定含有未成对电子 | |
| C. | R为第二周期元素,其原子具有的电子层数为最外层电子数的$\frac{1}{2}$,它可能形成的含氧酸根离子有 ①RO${\;}_{3}^{2-}$、②R2O${\;}_{4}^{2-}$、③RO${\;}_{4}^{2-}$ | |
| D. | Li、Be、B三种元素的第一电离能(I1)差别不大,而I2差别很大,则三种原子中最难失去第二个电子的是Be |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

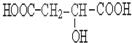 请回答:
请回答: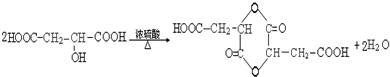 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
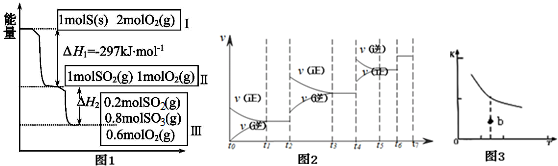
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL-1 | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL-1 | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL-1 | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com