
| A. | HCl═H++Cl- | B. | Ba(OH)2═Ba2++2OH- | ||
| C. | NaHCO3═Na++H++CO32- | D. | NaHSO4═Na++H++SO42- |
分析 A.盐酸为强酸完全电离出氢离子和氯离子;
B.氢氧化钡为二元强碱,完全电离出氢氧根离子和钡离子;
C.碳酸氢钠为弱酸的酸式盐,完全电离出钠离子和碳酸氢根离子;
D.NaHSO4是强酸的酸式盐,属于强电解质,NaHSO4在水中电离出钠离子和硫酸根离子和氢离子.
解答 解:A.盐酸为强酸完全电离:HCl═H++Cl-,故A正确;
B.氢氧化钡为二元强碱,完全电离:Ba(OH)2═Ba2++2OH-,故B正确;
C.碳酸氢钠在水中电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,故C错误;
D.NaHSO4是强电解质,NaHSO4在水中电离出钠离子和硫酸根离子和氢离子,电离方程式为:NaHSO4═Na++H++SO42-,故D正确;
故选C.
点评 本题考查电离方程式的书写知识,注意强电解质在溶液中能完全电离,弱电解质部分电离,离子团在电离方程式中不能拆开,强酸的酸式根离子要拆开,弱酸的酸式根离子不能拆开,碳酸氢钠电离为该题易错点,题目难度不大.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
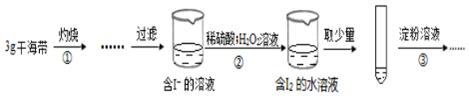
| A. | 步骤①需要将干海带放入坩埚中灼烧 | |
| B. | 步骤②反应的离子方程式为:2I-+2H++H2O2=I2+2H2O | |
| C. | 步骤③操作后,观察到试管中溶液变为蓝色,可以说明海带中含有碘元素 | |
| D. | 若步骤②仅滴加稀硫酸后放置一会儿,步骤③操作后,试管中溶液颜色无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2═2 Fe3++I2+4Br- | |
| C. | NaHSO4溶液中滴入少量Ba(OH)2溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+═Cl2+H2O↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,化学反应速率加快,反应的△H也随之减小 | |
| B. | 改变压强,平衡不发生移动,反应放出的热量不变 | |
| C. | 升高温度,反应速率加快,反应放出的热量不变 | |
| D. | 若在原电池中进行,反应放出的热量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L已烷含有的共价键总数为19NA | |
| B. | 1mol Cu与足量FeCl3溶液反应,转移的电子数为2NA | |
| C. | 1L 0.1mol•-1 Na2CO3溶液中CO32-和HCO3-离子数之和为0.1NA | |
| D. | 密闭容器中1.5molH2与0.5molN2充分反应,得到NH3的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
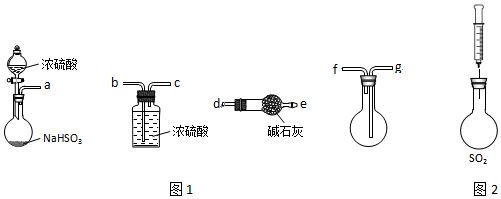
| 操作步骤 | 实验现象 | 解释原因 |
| 用注射器将新制H2S溶液注入充满SO2的烧瓶 | 产生乳白色浑浊 | +4价S有①氧化性 |
| 用注射器将 ②FeCl3溶液溶液注入充满SO2的烧瓶 | ③溶液由棕黄色变成浅绿色 | +4价S有还原性,反应的离子方程式为④2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,NA个H2和O2的混合气体的体积约为22.4 L | |
| B. | 1mol SiO2晶体中,含有2NA个Si-O键 | |
| C. | 0.1 mol Cl2溶解于一定体积的水中,转移电子数为0.2NA | |
| D. | 标准状况下,11.2 L H2O所含分子数为0.5 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com