
【题目】[化学——选修5:有机化学基础]
以芳香烃A为原料合成有机物F和I的合成路线如下: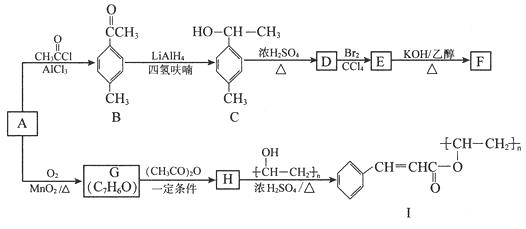
(1)A的分子式为 , C中官能团名称为。
(2)D分子中最多有个原子共平面。
(3)E生成F的反应类型为 , G的结构简式为。
(4)由H生成I的化学方程式为。
(5)符合下列条件的B的同分异构体有种(不考虑立体异构),其中核磁共振氢谱为4组峰且面积比为6∶2∶1∶1的是
(写出其中一种的结构简式)。
①属于芳香化合物 ②能发生银镜反应
(6)已知RCOOH ![]() RCOCl,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备
RCOCl,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备 ![]() 的合成路线。
的合成路线。
【答案】
(1)C7H8;羟基
(2)17
(3)消去反应;![]()
(4)
(5)14;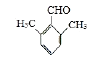 或
或 
(6)![]()
【解析】(1)由A→B的反应可推测A为甲苯,分子式为C7H8 , A→B的反应实质上是甲苯分子中甲基对位的氢原子被乙酰基取代的酰基化反应,从C的结构简式可知C中的官能团为羟基(一OH)。(2)D为C在浓硫酸作用下加热所得产物,且D能与Br2的CCl4溶液反应,则D应为C的消去反应产物——对甲基苯乙烯,根据乙烯分子和苯分子的平面结构可知,乙烯基中的5个原子共平面,苯环上的6个碳原子和4个氢原子共平面,当两平面重合时则有15个原子共平面,再把甲基碳原子及甲基上的1个氢原子计算在内,总共最多有17个原子共平面。(3) E→F的反应条件为K0H的乙醇溶液并加热,由此可判断该反应为卤代烃的消去反应。A→G的反应为甲苯的氧化反应,根据G的分子式C7H6O可判断该反应为甲苯分子中的甲基被氧化为醛基,所以G应为苯甲醛,结构简式为 ![]() 。(4)H→I的反应条件为浓硫酸并加热,可判断该反应为酯化反应,反应物之一为聚乙烯醇,从I的结构可判断发生该酯化反应的羧酸为3一苯基丙烯酸:
。(4)H→I的反应条件为浓硫酸并加热,可判断该反应为酯化反应,反应物之一为聚乙烯醇,从I的结构可判断发生该酯化反应的羧酸为3一苯基丙烯酸: ![]() ;
;
因此反应的化学方程式为  。(5)B的分子式为C9H10O的同分异构体属于芳香化合物,说明分子结构中必须有苯环,能发生银镜反应说明有醛基。当苯环上只有一个侧链时,则该侧链有2种结构:—CH2CH2CHO和—CH(CH3)CHO,因而有2种异构体,当苯环上有两个侧链时,侧链可以是—CH2CH3与—CHO的组合或—CH3与—CH2CHO的组合,再考虑两侧链在苯环上的相对位置可以是邻位、间位和对位,则两种组合各有三种共有6种异构体,当苯环上有三个侧链即两个甲基和一个醛时
。(5)B的分子式为C9H10O的同分异构体属于芳香化合物,说明分子结构中必须有苯环,能发生银镜反应说明有醛基。当苯环上只有一个侧链时,则该侧链有2种结构:—CH2CH2CHO和—CH(CH3)CHO,因而有2种异构体,当苯环上有两个侧链时,侧链可以是—CH2CH3与—CHO的组合或—CH3与—CH2CHO的组合,再考虑两侧链在苯环上的相对位置可以是邻位、间位和对位,则两种组合各有三种共有6种异构体,当苯环上有三个侧链即两个甲基和一个醛时
共有6种异构体,分别是两甲基处于邻位时有2种,两甲基处于间位时有三种,两甲基处于对位时有1种。综合以上分析可知共有14种同分异构体。其中核磁共振氢谱为4组峰且面积比为6:2:1:1的有两种,分别是  和片
和片  。(6)要制备
。(6)要制备 ![]() ,结合题中信息,应首先在苯环上引入一个丙酰基,然后用LiAlH4还原可得到,引入丙酰基的反应可采用类似于A→B的酰基化反应,而引入酰基所需的试剂丙酰氯可由丙酸在SOCl2作用下制取,所以合成该芳香醇只需三步即可宪成,具体的合成路线如下:
,结合题中信息,应首先在苯环上引入一个丙酰基,然后用LiAlH4还原可得到,引入丙酰基的反应可采用类似于A→B的酰基化反应,而引入酰基所需的试剂丙酰氯可由丙酸在SOCl2作用下制取,所以合成该芳香醇只需三步即可宪成,具体的合成路线如下: ![]()


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:
【题目】下列关系的表述中,正确的是( )
A.0.1mol?L﹣1NaHSO4溶液中:c(Na+)+c(H+)=c(SO ![]() )+c(OH﹣)
)+c(OH﹣)
B.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1
C.pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)不相等
D.0.1mol?L﹣1NaHCO3溶液中:c(Na+)>c(HCO ![]() )>c(CO
)>c(CO ![]() )>c(H2CO3)
)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),流程如下:
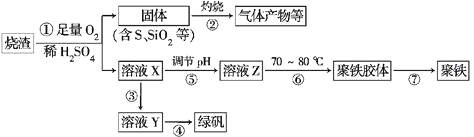
(1)将过程②中产生的气体通入下列溶液中,溶液会褪色的是________(填选项序号)。
a.品红溶液 b.紫色石蕊溶液 c.酸性KMnO4溶液 d.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为______________________
(3)过程③中,需加入的物质是____________;反应的化学方程式为_____________________
如何检验溶液Y中存在Fe2+?__________________________________________
(4)在实验室里,完成过程④的操作是____________(填操作名称),需要使用酒精灯、三脚架、坩埚钳等,还需要的陶瓷仪器有___________________________。
(5)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验:①用分析天平称取2.700 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁的主要成分为[Fe(OH)SO4]n,则聚铁样品中铁元素的质量分数为________。(假设杂质中不含铁元素和硫元素)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将3mol A和2mol B气体通入体积为2L的固定密闭容器中,发生反应:2A(g)+B(g)x C(g),2min时反应达到平衡状态(温度不变),剩余1.5mol B,并测得C的浓度为0.5mol/L.试求:
(1)x=;
(2)A的转化率为多少?
(3)t℃时该反应的平衡常数.(注:写出必要的计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中的实验操作能达到实验目的是( )
选项 | 实验操作 | 实验目的 |
A | 将浓硫酸和碳单质混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
B | 将NaOH的乙醇溶液加入溴乙烷中,加热,将产生的气体直接通入到酸性高锰酸钾溶液中,溶液褪色 | 证明溴乙烷的消去反应有乙烯生成 |
C | 先滴入Ba(NO3)2溶液,产生沉淀,加入足量稀盐酸,仍有沉淀 | 检验溶液中是否含有SO |
D | 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能合有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉定生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示。下列叙述错误的是
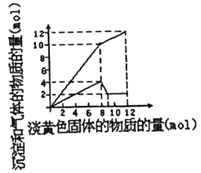
A. 溶液中一定含有的离子是NH4+、Al3+和Mg2+
B. 溶液中肯定不含有Cu2+,可能含有Fe2+
C. 所加的淡黄色固体是Na2O2
D. 溶液中的NH4+和Al3+的物质的量浓度之比3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: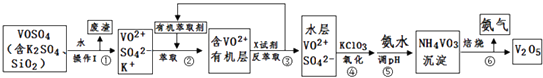
请回答下列问题:
(1)步骤①所得废渣的成分是(写化学式),操作I的名称 .
(2)步骤②、③的变化过程可简化为(下式R表示VO2+ , HA表示有机萃取剂):R2(SO4)n (水层)+2nHA(有机层)2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 .
③中X试剂为 .
(3)⑤的离子方程式为 .
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< .
(5)该工艺流程中,可以循环利用的物质有和 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法正确的是( )
A.含钙、钡、铁等金属元素的物质有绚丽的颜色,可用于制造焰火
B.将煤气化后再作为能源,可减少PM2.5引起的危害
C.用激光笔分别照射盛有蓝墨水、FeCl3溶液的玻璃杯均出现光亮的通路
D.氨气液化时能吸收大量的热,常用来做致冷剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com