
| A、Fe(OH)2 |
| B、Fe(OH)3 |
| C、K3Fe(CN)6 |
| D、Cu(NH3)4SO4 |
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
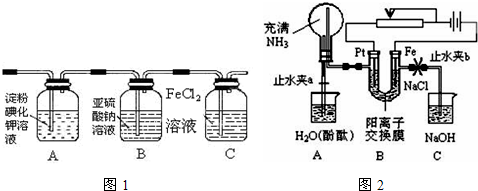
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加 | 若产生白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加 | 产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中 滴加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、依据相对分子质量的数据,推测乙醇和丙烷沸点的相对高低 |
| B、依据溶解度数据,选择用萃取的方法将粗溴提纯 |
| C、依据沸点数据,判断用分馏的方法从石油中获取汽油和煤油等 |
| D、依据苯与氢气加成反应的反应热数据与其他烯烃的加成反应对比,研究苯化学键的特征 |
查看答案和解析>>
科目:高中化学 来源: 题型:
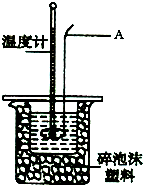 某实验小组用0.50mol?L-1NaOH溶液和0.50mol?L-1.1硫酸溶液进行中和热的测定.
某实验小组用0.50mol?L-1NaOH溶液和0.50mol?L-1.1硫酸溶液进行中和热的测定.| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.6 | 26.6 | 26.6 | 29.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是碱性氧化物 |
| B、可置于呼吸面具中提供O2 |
| C、无须密封保存 |
| D、投入水中会使溶液变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
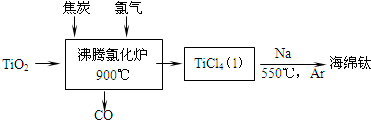
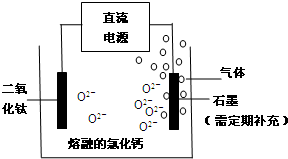
查看答案和解析>>
科目:高中化学 来源: 题型:
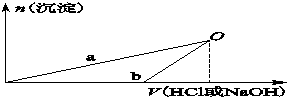 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.| 100ml稀盐酸 |
| NaOH溶液 |
| 100mlNaOH溶液 |
| 稀盐酸 |
| A、X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| B、b曲线表示的是向X溶液中加入NaOH溶液 |
| C、在O点时两方案中所得溶液浓度相等 |
| D、a、b曲线表示的反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0 mol?L-1KNO3溶液:H+、Fe 2+、SCN -、SO42- | ||
| B、pH=0的溶液:Al3+、Cu(NH3)42+、F -、SO42- | ||
| C、c(ClO-)=1.0mol?L-1的溶液:Na+、SO32-、S2-、SO42- | ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com