
分析 ①根据K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$计算平衡常数;
②平衡时c(NH3)=5mol/L,设氮气、氢气起始浓度分别为xmol/L、ymol/L,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol/L):x y 0
转化量(mol/L):2.5 7.5 5
平衡量(mol/L):x-2.5 y-7.5 5
结合平衡时氢气的浓度计算;
③结合平衡时氮气浓度计算氮气的起始浓度,N2的转化率=$\frac{浓度变化量}{起始浓度}$×100%.
解答 解:①平衡时c(N2)=3.5mol/L,c(H2)=11mol/L,c(NH3)=5mol/L,则平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{{5}^{2}}{3.5×1{1}^{3}}$=0.0054,
答:该温度下平衡常数为0.0054;
②平衡时c(NH3)=5mol/L,设氮气、氢气起始浓度分别为xmol/L、ymol/L,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol/L):x y 0
转化量(mol/L):2.5 7.5 5
平衡量(mol/L):x-2.5 y-7.5 5
平衡时c(H2)=11mol/L,则y-7.5=11,故y=18.5
答:氢气的起始浓度为18.5mol/L;
③平衡时,N2的浓度为3.5mol/L,则x-2.5=3.5,故x=6,N2的转化率=$\frac{2.5mol/L}{6mol/L}$×100%=41.7%,
答:平衡时氮气的转化率为41.7%.
点评 本题考查化学平衡计算,注意掌握三段式再化学平衡计算应用,难度不大.


科目:高中化学 来源: 题型:选择题
| 组别 | c(一元酸)/mol•L-1 | c(KOH)/mol•L-1 | 反应后溶液 |
| ① | c(HX)=0.10 | 0.1 | pH=b |
| ② | c(HY)=0.10 | 0.1 | pH=7 |
| ③ | c(HZ)=0.10 | 0.1 | pH=10 |
| ④ | c(HZ)=0.20 | 0.1 | pH<7 |
| A. | 实验①反应后的溶液中:c(X-)=0.05mol•L-1或c(X-)+c(HX)=0.05mol•L-1且不小于7 | |
| B. | 实验②反应时发生的离子方程式为H++OH-═H2O,则c(K+)=c(Y-)=c(OH-)=c(H+) | |
| C. | 实验③反应后的溶液中:c(K+)=c(Z-)=10-3 | |
| D. | 实验④反应后的溶液中:c(Z-)+c(OH-)<c(K+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③⑥ | C. | ③⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
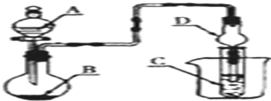
| A. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 | |
| B. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 | |
| C. | 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 | |
| D. | 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③⑤ | C. | ①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com