
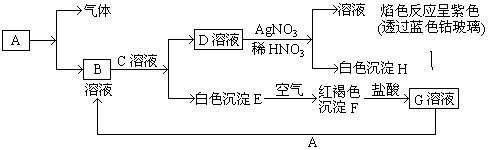
分析 白色沉淀E在空气中转化为红褐色沉淀F,则E为Fe(OH)2,F为Fe(OH)3,F与盐酸反应得到G,G与单质A反应得到B,结合转化关系及元素守恒可知,A为Fe,G为FeCl3,B为FeCl2,B与C溶液反应得到D,D与AgNO3生成白色沉淀H,可知H为AgCl,透过蓝色钴玻璃观察焰色反应为紫色,可知D溶液中含有K+,故D为KCl,C为KOH,金属单质A与稀盐酸反应会生成B溶液和放出气体H2,然后结合物质的性质及化学用语来解答.
解答 解:(1)由上述分析可知,B为FeCl2,D为KCl,故答案为:FeCl2;KCl;
(2)白色沉淀E在空气中转化为红褐色沉淀F,即Fe(OH)2在空气中与O2反应转变为Fe(OH)3,反应为4Fe(OH)2+2H2O+O2=4Fe(OH)3,
由D转变成H的离子方程式为:Cl-+Ag+═AgCl↓,故答案为:4Fe(OH)2+2H2O+O2=4Fe(OH)3;Cl-+Ag+═AgCl↓;
(3)G为FeCl3,A为Fe,则向G溶液加入A的化学方程式为:2FeCl3+Fe=3FeCl2;
故答案为:2FeCl3+Fe=3FeCl2.
点评 本题考查无机物的推断,E到F的颜色变化及焰色反应等时推断突破口,侧重铁及其化合物的性质及转化的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用NaOH溶液吸收尾气中的氯气:Cl2+4OH-═2ClO-+2H2O | |
| B. | SO2饱和溶液中NH4+、K+、CO32-、SO32-可大量存在 | |
| C. | 2Fe3++Fe═3Fe2+成立,说明氧化性:Fe3+>Fe2+ | |
| D. | 向NaHS溶液中加入适量硝酸发生反应:HS-+H+═H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1 KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42- | |
| C. | 在无色透明溶液中:Ba2+、Ca2+、NO3-、Cl- | |
| D. | 0.1 mol•L-1 FeCl3溶液:K+、NH+4、I-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
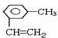 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
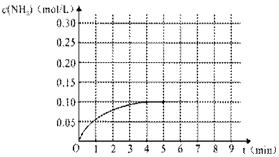 在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度的变化的情况如图:
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度的变化的情况如图:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO(g) | CO2(g) | NaOH 溶液、浓 H2SO4 | 洗气 |
| B | NH4Cl (aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C | Fe粉 | Al粉 | NaOH溶液 | 过滤 |
| D | Na2CO3(s) | NaHCO3(s) | - | 灼烧 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤法 | B. | 蒸馏法 | C. | 萃取法 | D. | 结晶法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com