
【题目】药物吗替麦考酚酯有强大的抑制淋巴细胞增殖的作用,可通过如下反应制得:

下列叙述正确的是
A. 用溴水可鉴别化合物X和Z B. 化合物Y的分子式为C6H13NO2
C. 化合物Z中含有手性碳原子 D. 1mol化合物Z可以与3mol NaOH反应
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】车辆碰撞瞬间,安全装置通电点火,使其中的粉末分解释放出大量保护气形成安全气囊。经分析确定气囊中粉末含有Na、Al、N、O四种元素,叠氮化钠(NaN3)经碰撞后会分解为Na、N2。
(1)氮原子的最外层电子排布式是______,氧原子核外有______种能量不同的电子,叠氮化钠固体中阴阳离子的个数比为1:1,则该固体中含有的化学键是______(填化学键名称)。
(2)在酸性溶液中,Al的最高价氧化物对应水化物的电离方程式为______。
(3)氮和氧两种元素,非金属性较强的是______,请用一个事实说明其强弱______。
工业上,通过如下转化可制得KClO3晶体:NaCl溶液![]() NaClO3溶液
NaClO3溶液![]() KClO3晶体
KClO3晶体
(4)①配平并完成Ⅰ中反应的总化学方程式,并用单线桥标出电子转移的方向和数目:______NaCl+______H2O![]() ______NaClO3+______
______NaClO3+______
②Ⅱ反应过程能析出KClO3晶体而无其它晶体析出的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出元素A名称______,元素B符号________,E原子电子式________
(2)C的简单离子结构示意图为_____________
(3)B单质在A单质中燃烧,反应现象是___________,生成物的化学式为___________
(4)A与E形成的化合物的电子式为__________,它的性质决定了它在物质的分类中应属于____________(酸性氧化物/碱性氧化物/两性氧化物)
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_________,写出化合物DE与过量烧碱反应的化学反应方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是( )

A.装置中存在“化学能→电能→光能”的转化
B.锌片上发生的电极反应为![]()
C.如果将稀硫酸换成柠檬汁,则导线中不会有电子流动
D.如果将锌片换成铁片,则电路中的电流方向不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应均可获取H2。下列有关说法正确的是
①焦炭与水反应制氢:C(s)+ H2O(g) = CO(g)+ H2(g) ΔH1 = 131.3 kJ·mol–1
②太阳光催化分解水制氢:2H2O(l) = 2H2(g)+ O2(g) ΔH2 = 571.6 kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g) = CO(g)+3H2(g) ΔH3 = 206.1 kJ·mol–1
A. 反应①为放热反应
B. 反应②中电能转化为化学能
C. 若反应③使用催化剂,ΔH3不变
D. 反应2H2(g) + O2(g) = 2H2O(g)的ΔH = -571.6 kJ·mol–1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为__(填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=___mol·L-1。
(2)煤燃烧排放的烟气中含有SO2和NOx,易形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
(____)ClO2-+(____)NO+(____)OH-=(____)Cl-+(____)NO3-+______
(3)为减少SO2对环境的污染,常将煤炭转化为清洁的气体燃料,并将烟气进行处理,吸收其中的SO2。
①写出焦炭与水蒸气反应的化学方程式:__。
②以下物质可以用来吸收烟气中SO2的是__(填字母代号)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(4)汽车尾气中NOx和CO的生成及转化。
①汽车启动时汽缸温度高,汽缸中会生成NO,化学方程式为___。
②汽车燃油不完全燃烧时产生CO。在汽车尾气系统中装上催化转化器可使CO和NO反应转化为无污染、无毒性的两种气体,其化学反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T 时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,
反应:PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 250 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s内的平均速率v(PCl3)=0.0032mol/(L·s)
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,该反应为放热反应
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前的v正>v逆
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物M的结构简式如下所示:
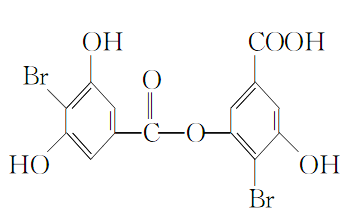
(1)M的分子式为__________。
(2)M分子中含氧官能团的名称为__________。
(3)下列有关M的叙述正确的是________(填字母代号)。
A.在浓硫酸存在时加热可发生消去反应
B.在酸性条件下可发生水解,得到两种不同的有机物
C.可与FeCl3溶液发生显色反应
D.该有机物1 mol与足量氢气充分反应,最多消耗8 mol氢气
(4)请写出M与过量热氢氧化钠溶液反应的化学方程式:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com