
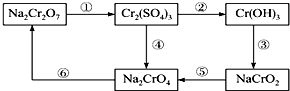
分析 (1)反应①所用的试剂是硫酸酸化的H2O2,Cr元素的化合价由+6价降低为+3价,则过氧化氢作还原剂;
(2)含Cr3+和Fe3+的溶液,使用NaOH溶液和盐酸,可将这两种离子相互分离,由图中转化可知Cr(OH)3具有两性,则加足量碱;
(3)Na2SO3被Na2Cr2O7氧化为Na2SO4,S元素的化合价升高,Cr元素的化合价降低,结合电子守恒计算;
(4)步骤⑤中Cr元素的化合价由+3价升高为+6价,以此来解答.
解答 解:(1)过氧化氢既具有氧化性又有还原性,重铬酸根具有强氧化性,能将过氧化氢氧化为氧气,反应中+6价的铬元素被还原为+3价,离子方程式为;Cr2O72-+8H++3H2O2═2Cr3++3O2↑+7H2O,故答案为:Cr2O72-+8H++3H2O2═2Cr3++3O2↑+7H2O;
(2)从反应③可以看出,氢氧化铬可以和氢氧化钠反应生成NaCrO2,所以除去铁离子中的铬离子时可以加入过量的氢氧化钠,是铬离子转化为CrO2-(或NaCrO2),铁离子变成Fe(OH)3沉淀,在过滤得到氢氧化铁沉淀中加入盐酸即得到氯化铁溶液,
故答案为:CrO2-(或NaCrO2);Fe(OH)3;
(3)Na2SO3被Na2Cr2O7氧化为Na2SO4,S元素的化合价升高,Cr元素的化合价降低,设铬元素在产物中的化合价为a价,由电子转移守恒可知,则24×10-3L×0.05mol/L×(6-4)=20×10-3L×0.02mol/L×2×(6-a),解得a=+3,
故答案为:+3;
(4)步骤⑤中铬元素的化合价从+3升高到+6,所以需要加入氧化剂,故答案为:氧化.
点评 本题考查氧化还原反应及计算,为高频考点,把握物质的性质、发生的反应及反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意(3)中电子守恒的应用,题目难度中等.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 空气中结构式为O-C-O的分子含量过多会造成温室效应 | |
| B. | 结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| C. | 球棍模型为 的分子可发生加成反应 的分子可发生加成反应 | |
| D. | 电子式分别为Na+[ ]2-Na+和 ]2-Na+和 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将汽油标准由“国IV”提到“国V”,以降低汽车尾气污染 | |
| B. | 积极推广太阳能、风能等新能源的使用,减少化石燃料的使用 | |
| C. | 加强城市生活污水脱氮除磷处理,遏制水体富营养化 | |
| D. | 加高烟囱,减少烟尘对周围环境的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正戊烷、新戊烷、异戊烷互为同分异构体 | |
| B. | 扁桃酸( )属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种 )属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种 | |
| C. |  互为同系物 互为同系物 | |
| D. | 四氯乙烯分子中所有原子都处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验装置 | 现象 |
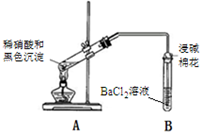 | 1A试管中黑色沉淀逐渐溶解 2A试管内上方出现红棕色气体 3B试管中出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 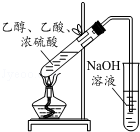 实验室中制取少量的乙酸乙酯 | |
| B. |  比较硫、碳、硅三种元素的非金属性强弱 | |
| C. | 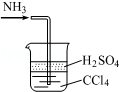 处理尾气 | |
| D. | 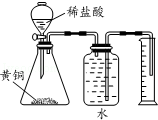 测定黄铜(Cu、Zn合金)中Zn 的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该温度下,加入NaHSO4可能引起由b向a的变化 | |
| B. | 该温度下,pH=2的盐酸与pH=12的氢氧化钠溶液等体积混合,所得溶液显中性 | |
| C. | 该温度下,加入Na2CO3溶液能引起b向c的变化 | |
| D. | 降低温度可能引起b向d的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 面粉-淀粉 | B. | 牛肉-蛋白质 | C. | 桔子-维生素 | D. | 梅子蜜饯-防腐剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com