
| A. |  氢气 | B. |  氨气 | C. |  水 | D. |  二氧化碳 |
科目:高中化学 来源: 题型:选择题
| A. | 0.05 mol•L-1 | B. | 0.1 mol•L-1 | C. | 0.2 mol•L-1 | D. | 0.3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al、Cu、AgNO3 | B. | Na2O2、Na2SO3、BaCl2 | ||
| C. | CaCO3、Na2SiO3、CH3COONa | D. | Ba(NO3)2、Fe(OH)2、NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑧ | B. | ④⑤⑦ | C. | ③⑤⑦ | D. | ③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 现象及结论 | |
| Ⅰ | 打开活塞a,滴加氯水,关闭活塞 | A中溶液变为红棕色 |
| Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
| Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
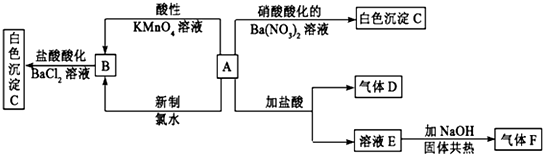
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、NH4+、Cl-、SO42- | B. | Na+、CH3COO-、K+、CO32- | ||
| C. | Fe2+、Cl-、Na+、NO3- | D. | K+、NO3-、Cl-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com