
下列说法正确的是( )
A.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C.浓H2SO4具有强氧化性,常温下就能与金属Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D.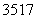 Cl与
Cl与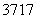 Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
能大量共存于同一溶液中,且当溶液中加入过量的NaOH溶液或少量稀硫酸时,都能产生白色沉淀的离子组是( )
A.Ba2+、Mg2+、NO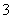 、CO
、CO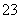 B.H+、Ba2+、Al3+、Cl-
B.H+、Ba2+、Al3+、Cl-
C.K+、Ba2+、Cl-、HCO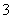 D.NH
D.NH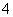 、Ba2+、Fe3+、Cl-
、Ba2+、Fe3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.在0℃时,22.4 L氢气中含有2NA个氢原子
B.电解食盐水若产生2 g氢气,则转移的电子数目为NA
C.1 mol乙烷分子中共价键总数为7NA
D.密闭容器中46 g NO2含有的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
常见非金属元素及化合物的特征性质和应用
(1)C、N、O、Si、S、Cl等元素形成的单质中:
①属于空气主要成分的是__________,它们相互反应的化学方程式
________________________________________________________________________;
②常用于自来水消毒的是________,它与NaOH溶液反应的离子方程式
________________________________,实验室制备该气体的化学方程式
________________________________________________________________________;
③属于半导体材料的是__________,其工业制取方法是
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与社会、环境等密切相关。下列说法错误的是( )
A.“低碳经济”是指减少对化石燃料的依赖,达到低污染、低排放的模式
B.“低碳生活”倡导生活中耗用能量尽量减少,从而减少CO2的排放
C.所有垃圾都可以采用露天焚烧或深埋的方法处理
D.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量
查看答案和解析>>
科目:高中化学 来源: 题型:
FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2。某化学研究小组为探究在酒精喷灯加热条件下FeSO4分解的气体产物,进行了一系列实验。已知SO3的熔点是16.8 ℃,沸点是44.8 ℃。
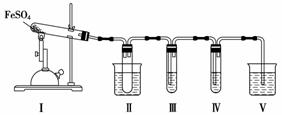
请回答下列问题:
(1)装置Ⅱ的试管中不装任何试剂,其作用是__________________________,试管浸泡在50 ℃的水中,其目的是____________________。
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验中气体产物的成分。请完成实验设计,填写检验试剂、预期现象与结论。限选试剂:3 mol·L-1 H2SO4溶液、6 mol·L-1 NaOH溶液、0.5 mol·L-1 BaCl2溶液、0.5 mol·L-1 Ba(NO3)2溶液、0.01 mol·L-1酸性KMnO4溶液、0.01 mol·L-1溴水。
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中装有______________ | 产生大量白色沉淀,证明气体产物中含有SO3 |
| 装置Ⅳ的试管中装有____________ |
(3)装置Ⅴ的作用是防止尾气污染环境,烧杯中应加入的试剂是__________。
(4)已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入适量硫酸,溶液立即变黄。
①甲同学推测该反应的还原产物有两种可能:a.Cl2、b:Cl-。
乙同学结合甲同学的推测,认为其中一种可能可以排除,你认为可以排除的是哪种可能,并用简要的文字和离子方程式说明理由:________________。
②上述反应的离子方程式为__________________。
③为检验上述反应中的还原产物,请选择所需实验步骤,并按先后次序排列:__________(填序号)。
A.取一支试管,加入上述反应后的溶液少许
B.加入过量Ba(NO3)2溶液,出现白色沉淀
C.过滤;取滤液加入硝酸酸化的AgNO3溶液,出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:X(g)+3Y(g)⇌2Z(g)+aQ(g)。2 min达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol/L,下列叙述错误的是( )
A.a的值为1 B.平衡时X的浓度为0.8 mol/L
C.Y的转化率为60% D.反应速率v(Y)=0.3 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
在某恒温、恒容的密闭容器内发生反应:2NO2g)2NOg)+O2g) ΔH>0,开始时充入2 mol NO2并达到平衡,下列说法正确的是 )。
A.再充入2 mol NO2,平衡正向移动,O2的体积分数增大
B.升高温度,O2的体积分数减小
C.增大压强,化学平衡逆向移动,NO2的体积分数增大
D.再充入1 mol O2,NO2的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com