
【题目】化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆 开)1mol 化学键时释放(或吸收)的能量。已知白磷和![]() 的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P—P:198,P—O:360,O=O:498,则对于反应
的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P—P:198,P—O:360,O=O:498,则对于反应![]() 表述正确的是 ( )
表述正确的是 ( )
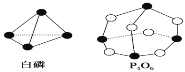
A.放出1638 kJ 的热量B.吸收1638 kJ 的热量
C.放出126 kJ 的热量D.吸收126 kJ 的热量
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.Zn+H2SO4=ZnSO4+H2↑;B.NaOH+HCl=NaCl+H2O。能设计成原电池的反应是__________(填“A”或“B”)。
(2)将锌片和铜片按如图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置
B.甲中铜片质量减少、乙中锌片质量减少
C.两烧杯中溶液的c(H+)均减小
②在相同时间内,两烧杯中产生气泡的速度:甲__________乙(填“>”、“<”或“=”)。
③请写出图中构成原电池的正极电极反应式:__________。
④当乙中产生2.24 L(标准状况)气体时,将锌铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.2 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
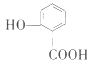
【题目】下面的排序不正确的是
A. 晶体的熔点:![]() >
>
B. 晶格能的大小: Al2O3>MgCl2>NaCl
C. 共价键的键长: F-F>C-Cl>C-S>Si-O
D. 硬度由大到小:金刚石>氮化硅>晶体硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关,下列有关说法不正确的是
A. 富脂食品包装中常放入活性铁粉袋,以防止油脂氧化变质
B. 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造晶体管
C. Ni-Zn化合物的纳米颗粒可作![]() 反应的催化剂,提高苯的转化率
反应的催化剂,提高苯的转化率
D. 用K2FeO4代替Cl2处理饮用水时,既有杀菌消毒作用,又有净水作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碳化硅(SiC)是一种晶体,具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。下列各种晶体:①晶体硅 ②硝酸钾 ③金刚石 ④碳化硅 ⑤干冰 ⑥冰,它们的熔点由高到低的顺序是___________(填序号)。
(2)下列离子晶体的立体构型示意图,如下图所示。
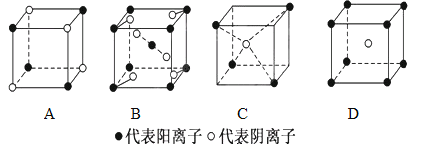
以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式。
A.__________,B:________,C:________,D:_____________。
(3)已知FeS2晶体(黄铁矿的主要成分)具有A的立体结构。
①FeS2晶体中具有的化学键类型是______________。
②若晶体结构A中相邻的阴、阳离子间的距离为acm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确且与对应操作和目的相符的是
选项 | 目的 | 操作 | 离子方程式 |
A | 比较Fe2+和Br还原性强弱 | 向FeBr2溶液中滴入少量氯水 | 2Br+Cl2=Br2+2Cl |
B | 比较C、Si非金属性强弱 | 向硅酸钠溶液中通入少量二氧化碳 | SiO32-+CO2+H2O=H2SiO3↓+CO32- |
C | 除去CO2中的SO2 | 将气体通入盛有饱和碳酸氢钠溶液的洗气瓶 | CO32-+SO2= SO32-+CO2 |
D | 实验室制取氯气 | 向MnO2固体中加入浓盐酸并加热 | MnO2+4HCl(浓) +2Cl +Cl2↑+2H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组为探究ClO-、I2、SO![]() 在酸性条件下的氧化性强弱,设计实验如下:
在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉-碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:__________________________。
(2)实验②的化学反应中转移电子的物质的量是___________________。
(3)以上实验说明,在酸性条件下ClO-、I2、SO![]() 的氧化性由弱到强的顺序是________________。
的氧化性由弱到强的顺序是________________。
Ⅱ.(4)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________(填序号)。
A.Cl2 B.H2O2
C.ClO2 D.O3
(5)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是_______________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的 NO 和![]() ,在一定条件下发生反应:
,在一定条件下发生反应:![]() 。
。
①能说明该反应已达到平衡状态的标志是________________。
a.反应速率 v(![]() )=v(
)=v(![]() )
)
b.容器内压强不再随时间而发生变化
c.容器内 ![]() 的物质的量分数不再随时间而发生变化
的物质的量分数不再随时间而发生变化
d.容器内 n(NO)∶n(![]() )∶n(
)∶n(![]() )∶n(
)∶n(![]() ) = 6∶4∶5∶6
) = 6∶4∶5∶6
e.12mol N-H键断裂的同时生成 5mol N≡N 键
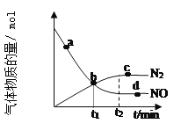
②某次实验中测得容器内 NO 及![]() 的物质的量随时间变化如图所示,图中 b 点 对应的速率关系是 v(正 )_____v(逆);d 点对应的速率关系是 v(正)_____v(逆)。
的物质的量随时间变化如图所示,图中 b 点 对应的速率关系是 v(正 )_____v(逆);d 点对应的速率关系是 v(正)_____v(逆)。
(填﹥、﹤或﹦)
(2)一定条件下,在 2L 密闭容器内,反应![]() ,n(
,n(![]() )随时间 变化如下表:
)随时间 变化如下表:
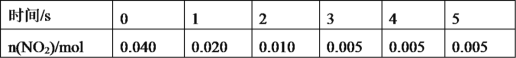
①用![]() 表示 0~2 s 内该反应的平均速率为_____。在第 5s 时,
表示 0~2 s 内该反应的平均速率为_____。在第 5s 时,![]() 的转化率为______。
的转化率为______。
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2甲基丁烷。若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )
A.CH3CH2CH2CH2CH2OH B.(CH3)2COHCH2CH3
C.(CH3)2CHCH2CH2OH D.(CH3)3CCH2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com