
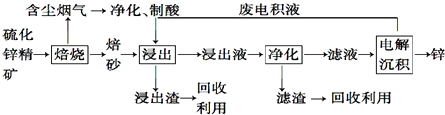
分析 硫化锌精矿的焙烧可生成ZnO、氧化铁等,含尘烟气含有含硫氧化物,可用于制备硫酸,浸出液加入硫酸可生成硫酸锌、硫酸铁,加入过量锌充分反应,可置换出铁,滤液中主要含有硫酸锌,经电解可得到锌和硫酸,电解液中含有硫酸,可循环利用,
(1)硫化锌精矿主要成分是ZnS,ZnS在氧气燃烧发生氧化还原反应,据此判断锌的存在形式;
(2)ZnS在氧气燃烧发生氧化还原反应生成产物出来氧化锌外还有硫的氧化物,可转换为硫酸,用于后续的浸出操作;
(3)锌的活泼性强于铁,能够与二价铁离子反应生成铁;
(4)电解沉积过程中,是电解ZnSO4,阳极发生氧化反应,据此判断产物;
(5)依据题意“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质,可知反应物中含有H+和O2,可以获得非金属单质S,据此写出方程式;
(6)由题意可知:反应物为ZnCO3和C,产物含有Zn,根据反应物和生成物写出化学方程式.
解答 解:硫化锌精矿的焙烧可生成ZnO、氧化铁等,含尘烟气含有含硫氧化物,可用于制备硫酸,浸出液加入硫酸可生成硫酸锌、硫酸铁,加入过量锌充分反应,可置换出铁,滤液中主要含有硫酸锌,经电解可得到锌和硫酸,电解液中含有硫酸,可循环利用,
(1)ZnS在氧气燃烧发生氧化还原反应,所以产生焙砂的主要成分的化学式为ZnO,
故答案为:ZnO;
(2)ZnS在氧气燃烧发生氧化还原反应生成产物出来氧化锌外还有硫的氧化物,可转换为硫酸,用于后续的浸出操作,
故答案为:浸出;
(3)该含锌矿中还含有FeS等杂质,浸出操作后转化为亚铁离子,可加入锌粉出去亚铁离子,离子方程式:Zn+Fe2+=Zn2++Fe,
故答案为:锌粉;置换出Fe等;
(4)电解沉积过程中,是电解ZnSO4,阳极发生氧化反应,氢氧根离子在阳极上失去电子发生氧化反应生成氧气,
故答案为:O2;
(5)“氧压酸浸”法顾名思义,可知反应物中含有H+和O2,可以获得非金属单质S,化学方程式为:2ZnS+4H++O2=2Zn2++2S↓+2H2O,
故答案为:2ZnS+4H++O2=2Zn2++2S↓+2H2O;
(6)由题意可知:反应物为ZnCO3和C,产物含有Zn,化学方程式:ZnCO3+2C $\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑,
故答案为:ZnCO3+2C $\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑.
点评 本题为工艺流程题,通过锌的炼制考查了化学方程式、离子方程式的书写,明确工艺流程及各种物质的性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 反应进行到5 s时,v(A)=v(B)=v(C)=v(D) | |
| B. | 反应进行到5 s时,B的平均反应速率为0.06mol/(L•s) | |
| C. | 反应进行到1 s时,v(A)=v(B) | |
| D. | 该反应的化学方程式为6A+2D?3B+4C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性 | |
| B. | 医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于盐酸 | |
| C. | 向50 mL 18 mol•L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol | |
| D. | 常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 邻二甲苯只有一种结构,能证明苯环中不存在碳碳单键和碳碳双键交替的结构 | |
| B. | 高聚物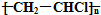 的单体可以通过乙烯和HCl加成制得 的单体可以通过乙烯和HCl加成制得 | |
| C. | (CH3)2CH-CH=CH-C(CH3)3与氢气加成后的产物用系统命名法命名为2,2,5-三甲基己烷 | |
| D. | 完全燃烧一定质量的冰醋酸、葡萄糖混合物(以任意质量比混合),生成CO2和H2O的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 榄香烯的分子式为C15H20 | |
| B. | 榄香烯属于芳香烃 | |
| C. | 1 mol 榄香烯最多能和6 mol H2反应 | |
| D. | 榄香烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
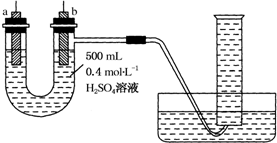 实验室提供纯锌、纯铜片和500mL 0.4mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.
实验室提供纯锌、纯铜片和500mL 0.4mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com