
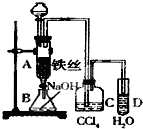
 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.分析 根据实验装置可知,将溴和苯的混合物滴入到铁丝上,在铁作催化剂的条件下苯和溴发生取代反应生成溴苯和溴化氢,溴和苯都是易挥发的物质,所以C装置中用四氯化碳吸收溴化氢气体中的苯和溴,生成的溴化氢用水吸收,注意要防止倒吸,所以导管口中液面上方,A中反应后的溶液放到B中,用氢氧化钠溶液除去溴苯中的溴,(1)铁与溴会生成溴化铁,苯和液溴在溴化铁催化作用下发生取代反应生成溴苯和溴化氫;
(2)溴化氢易溶于水,氢溴酸易挥发;
(3)溴能与氢氧化钠反应而溴苯不能;
(4)CCl4 能溶解溴不能溶解溴化氢;
(5)如果苯和液溴发生的是取代反应,则有HBr生成,如果发生的是加成反应,则无HBr生成.
解答 解:(1)A中铁与溴会生成溴化铁,反应方程式为2Fe+3Br2=2FeBr3,在FeBr3的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成:C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr,
故答案为:2Fe+3Br2=2FeBr3;C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr;
(2)由于溴化氢易溶于水,氢溴酸易挥发,所以D中可观察到有雾状物质出现,
故答案为:有雾状物质出现;
(3)溴单质能与氢氧化钠溶液反应而溴苯不能,反应方程式:Br2+2NaOH═NaBr+NaBrO+H2O,
故答案为:除去溶于溴苯中的溴;Br2+2NaOH═NaBr+NaBrO+H2O;
(4)CCl4 能溶解溴不能溶解溴化氢,四氯化碳能除去溴化氢气体中的溴蒸气和苯,
故答案为:除去溴化氢气体中的溴蒸气;
(5)如果苯和液溴发生的是取代反应,则有HBr生成,如果发生的是加成反应,则无HBr生成.也就是说,如果要证明苯和液溴发生的是取代反应,而不是加成反应,只需检验有无HBr生成.可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明发生取代反应,我们再回答出检验H+的方法即可,可用石蕊试液,若变红则发生取代反应.但溴易挥发,溴化氢气体中的溴蒸气对溴化氢的检验有干扰作用,因此,在检验溴化氢前必须除去溴蒸气,这也正是C中盛放的CCl4的作用,
故答案为:AgNO3溶液或石蕊试液;产生淡黄色沉淀或溶液变红色.
点评 本题考查苯的取代反应方程式及实验现象以及产物HBr的检验,题目难度中等,注意掌握苯的取代反应原理,明确反应的产物及HBr的化学性质进行解题.


科目:高中化学 来源: 题型:选择题
| A. | 主族元素的电负性越大,元素原子的第一电离能一定越大 | |
| B. | 在元素周期表中,元素电负性从左到右越来越小 | |
| C. | 在形成化合物时,电负性越小的元素越容易显正价 | |
| D. | 金属元素的电负性一定小于非金属元素的电负性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量样品→加热→冷却→称量CuO | |
| B. | 称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 | |
| C. | 称量样品→加热→冷却→称量Cu(NO3)2 | |
| D. | 称量样品→加NaOH→过滤→加热→冷却→称量CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅能表示化学反应中伴随放出热量多少的化学方程式 | |
| B. | 能够表示化学反应中热效应的化学方程式 | |
| C. | 热效应的大小与反应的温度、压强无关,只与反应物和生成物的状态有关 | |
| D. | 当多步反应中热化学方程式相加时,相对应的热量要相减 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,正向反应速率减小,逆向反应速率增大 | |
| B. | 升高温度有利于正、逆反应速率增大,从而缩短达到平衡的时间 | |
| C. | 达到平衡后,升高温度或增大压强都有利于该反应平衡逆向移动 | |
| D. | 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
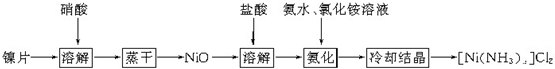
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
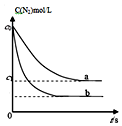 汽车尾气中,产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
汽车尾气中,产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( )| A. | 若曲线b对应的条件改变是温度,可判断该反应的△H<0 | |
| B. | 温度T下,随着反应的进行,混合气体的密度减小 | |
| C. | 曲线b对应的条件改变可能是加入了催化剂 | |
| D. | 温度T下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{c}_{1}^{2}}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com