
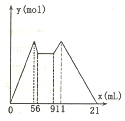
 如图是向MgCl2、A1C13混合溶液中先滴加试剂A,然后改滴试剂B,所得沉淀的物质
如图是向MgCl2、A1C13混合溶液中先滴加试剂A,然后改滴试剂B,所得沉淀的物质| A. | 原混合液中,c(A13+):c(Mg2+):c(C1)=1:1:5 | |
| B. | 若A和B为一元强碱和一元强酸,则滴加7.5mL剂A后改滴试剂B | |
| C. | 若A是NaOH,B是盐酸,则c(NaOH):c(HC1)=2:1 | |
| D. | 从6到9,相应离子反应方程式H++OH-═H2O |
分析 根据图象知,MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,加入A立即产生沉淀,NaOH和MgCl2、AlCl3反应生成沉淀而HCl不反应,所以A是NaOH,B是HCl;5mL、11mL时沉淀质量最大,且相等,为Al(OH)3、Mg(OH)2沉淀,生成两种沉淀消耗5mLNaOH、沉淀完全溶解消耗10mLHCl,相当于酸碱反应,酸碱以1:1反应,二者体积之比为1:2,则c(NaOH):c(HCl)=2:1;5-6mL时是NaOH溶解氢氧化铝沉淀,消耗1mL,则生成氢氧化铝沉淀消耗NaOH体积应该是3mL,0-5mL为生成Al(OH)3、Mg(OH)2沉淀,其中2mL为生成Mg(OH)2沉淀,所以生成Al(OH)3、Mg(OH)2沉淀消耗NaOH体积分别是3mL、2mL,根据关系式知,c(Al3+):c(Mg2+)=1:1,据此进行解答.
解答 解:A.从加入5 mL A生成沉淀最多,再继续加1 mL A沉淀量减少到最小值,相应反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,由此可知,n(Al3+)=n〔Al(OH)3〕=(1×c×10-3) mol;由前5 mL NaOH形成最大沉淀量可知,2n(Mg2+)+3n(Al3+)=(5×10-3×c)mol,所以n(Mg2+)=(1×c×10-3) mol;溶液中阴阳离子所带电荷相等得,n(Cl-)=(5×10-3×c)mol,即溶液中c(Mg2+):c(Al3+):c(Cl-)=1:1:5,故A正确;
B.6~9mL之间为碱与酸反应,由于c(NaOH):c(HCl)=2:1,二者物质的量相等,故二者体积之比为1:2,则发生中和反应的NaOH溶液体积为3mL×$\frac{1}{3}$=1mL,盐酸为3mL-1mL=2mL,故整个过程中NaOH溶液总体积为:6mL+1mL=7mL,则滴加7mL剂A后改滴试剂B,故B错误;
C.根据加入前6 mL试剂时,先有沉淀生成而后溶解,所以试剂A是NaOH,则B是盐酸,生成两种沉淀消耗5mLNaOH、沉淀完全溶解消耗10mLHCl,相当于酸碱反应,酸碱以1:1反应,二者体积之比为1:2,则c(NaOH):c(HCl)=2:1;故C正确;
D.由6mL和9mL对应液体中沉淀量相等,可以推知此时仅仅发生酸碱中和反应,即H++OH-=H2O,故D正确;
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,明确图象中曲线变化对应的反应实质为结构件,注意掌握镁离子、铝离子等化学性质,试题培养了学生的化学计算能力.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | 5.6gFe在氧气中燃烧,完全反应时转移电子数为0.3NA | |
| B. | 标准状况下,4.48L氦气中所含原子数为0.2NA | |
| C. | NA个Fe(OH)3胶体粒子的质量为107g | |
| D. | 带温下,l.7gNH3和3.65gHCl混合后,气体分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷 | |
| B. | 用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 | |
| C. | 用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 | |
| D. | 向苯酚钠溶液中通入少量CO2,溶液变浑浊,反应为:2C6H5ONa+CO2→2C6H5OH+Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl、Br2 | B. | NaCl、KCl | C. | KI、NaCl | D. | NaCl、KCl、I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| B | 向稀硝酸中加入少量铁粉 | 有气泡产生 | 说明Fe置换出硝酸中的氢,生成了氢气 |
| C | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色胶状物质 | H2CO3的酸性比H2SiO3的酸性强 |
| D | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | NaHCO3为难溶物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 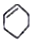 属于芳香族化合物 属于芳香族化合物 | B. | 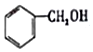 属于酚类化合物 属于酚类化合物 | ||
| C. | 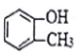 属于脂环化合物 属于脂环化合物 | D. | CH3CH2CH(CH3)2属于链状化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
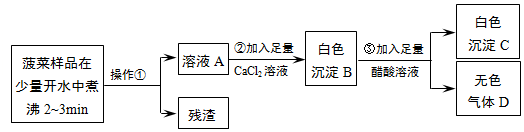
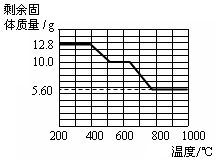
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
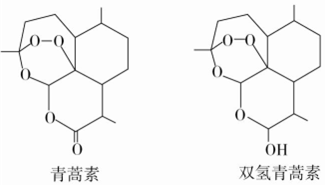
| A. | 双氢青蒿素的分子式为 C15H24O5 | |
| B. | 双氢青蒿素分子中有2个六元环和2个七元环 | |
| C. | 青蒿素分子中含有过氧键、酯基和醚键 | |
| D. | 由青蒿素制备双氢青蒿素的反应属于还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com