
| 时间 | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
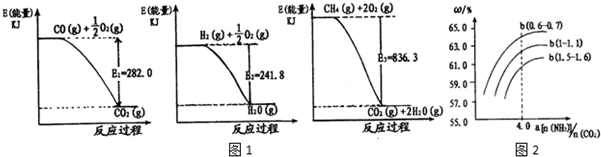
分析 (1)分别根据图象1、2、3写出热化学方程式,然后根据盖斯定律来分析;
(2)(i).①根据方程式可知,n1=0.3mol,n2=0.07mol,n3=0.24mol,n4=0.24mol,根据NO2的平衡浓度为0.12mol/L、N2O4的平衡浓度为0.04mol/L来计算;
②若最初通人N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,即与通入0.4molNO2达等效平衡,据此分析;
(ii)根据题目信息写出方程式,建立关系式,然后依据关系式进行计算;
(3)①根据氨碳比a[n(NH3)/n(CO2)]相同时,水碳比b[n(H2O)/n(CO2)]为0.6~0.7时,二氧化碳转化率最大;
②根据氨碳比a[n(NH3)/n(CO2)]大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本;氨碳比a[n(NH3)/n(CO2)]小于4.0时,二氧化碳的转化率较小;
解答 解:(1)分别根据图象1、2、3可知热化学方程式为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282KJ/mol ①
H2(g)++$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol ②
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-836.3KJ/mol ③
将③-①-②×3可得:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+171.1KJ/mol,故答案为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+171.1KJ/mol;
(2)(i)①根据方程式中物质间的计量数关系、利用三段式可知,n1=0.3mol,n2=0.07mol,n3=0.24mol,n4=0.24mol,故在60min时反应达平衡,NO2的平衡浓度为0.12mol/L、N2O4的平衡浓度为0.04mol/L,故反应的平衡常数K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=$\frac{0.04}{0.1{2}^{2}}$=2.8,故答案为:2.8;
②若最初通人N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,即与通入0.4molNO2达等效平衡,而在恒温恒容条件下,按照等量加料,则达等效平衡,故应加入0.2molN2O4,即0.1mol/L,故答案为:0.1mol/L;
(ii)由题目信息可知,NO、NO2二者混合物与水反应生成亚硝酸,反应方程式为NO+NO2+H2O=2HNO2;亚硝酸再与尿素反应生成CO2和N2,反应方程式为CO (NH2)2+2HNO2=CO2+2N2+3H2O.
NO+NO2 ~2HNO2 ~CO(NH2)2
(30+46)g 1mol
1mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1:1)的质量为76g,故答案为:76;
(3)①氨碳比a[n(NH3)/n(CO2)]相同时,水碳比b[n(H2O)/n(CO2)]为0.6~0.7时,二氧化碳转化率最大,故答案为:C;
②氨碳比a[n(NH3)/n(CO2)]大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本;氨碳比a[n(NH3)/n(CO2)]小于4.0时,二氧化碳的转化率较小,
故答案为:氨碳比a[n(NH3)/n(CO2)]大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本;氨碳比a[n(NH3)/n(CO2)]小于4.0时,二氧化碳的转化率较小.
点评 本题主要考查了盖斯定律的应用,化学平衡移动、化学平衡常数的计算等,难度不大,培养了学生分析问题的能力.


科目:高中化学 来源: 题型:解答题
 (1)某同学用碳棒,铜棒,稀硫酸和干电池为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑请在右边画出能够实验这一反应的装置图.
(1)某同学用碳棒,铜棒,稀硫酸和干电池为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑请在右边画出能够实验这一反应的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的BaCl2溶液 | 出现白色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,运输浓硫酸、浓硝酸时可用铝制或铁制槽车 | |
| B. | 用氯化钡溶液可区别SO42-和CO32-离子 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 二氧化硅是一种酸性氧化物,它不跟任何酸发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 高温或日常用的消毒剂可使禽流感病毒蛋白质变性 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液和胶体的本质区别是丁达尔效应 | |
| B. | 液氨、氨水属于纯净物,盐酸和豆浆属于混合物 | |
| C. | 胶体区别于其它分散系的本质特征是粒子大小 | |
| D. | 能进行“交叉分类”的就不能进行“树状分类” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com