
| A. | 1mol/L | B. | 2mol/L | C. | 2.5mol/L | D. | 3mol/L |
分析 铂电极为惰性电极,电解HNO3与AgNO3 的混合溶液,通电一段时间后,两极均收集到2.24L气体(标准状况),阴极发生2Ag++2e-=2Ag、2H++2e-=H2↑,阳极发生4OH--4e-=2H2O+O2↑,以此进行计算.
解答 解:铂电极为惰性电极,电解HNO3与AgNO3 的混合溶液,通电一段时间后,两极均收集到2.24L气体(标准状况),
n(气体)=$\frac{2.24L}{22.4L/mol}$=0.1mol,由阳极发生4OH--4e-=2H2O+O2↑可知,生成0.1molO2转移0.4mol电子,
根据电子守恒可知,阴极转移0.4mol电子,则
2H++2e-=H2↑
0.2mol 0.1mol
2Ag++2e-=2Ag
0.2mol 0.2mol
即n(Ag+)=0.2mol,
则原混合溶液中Ag+的物质的量浓度为$\frac{0.2mol}{0.1L}$=2mol/L,
故选B.
点评 本题考查电解原理及氧化还原反应的计算,明确发生的电极反应及电子守恒是解答本题的关键,注意阴极银离子先放电为解答的易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
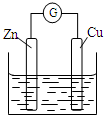
| A. | 铜电极上发生还原反应 | B. | 锌电极是原电池的负极 | ||
| C. | 电子从铜极经过外电路流向锌极 | D. | 锌电极上的反应为Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应中反应物所具有的总能量高于生成物所具有的总能量 | |
| B. | 2 mol N原子结合生成N2(g)时需要放出946 kJ能量 | |
| C. | 1 mol NO(g)分子中的化学键断裂时需要放出632 kJ能量 | |
| D. | 该反应的热化学方程式为:N2+O2═2NO△H=+180 kJ/mol. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Rn的原子核内中子数与质子数的差值为50 | |
| B. | Rn位于元素周期表中第六周期0族 | |
| C. | Rn的最外层电子排布式为6s26p6,化学性质不活泼 | |
| D. | 新铺大理石地面的居室,不用打开门窗换气,因为氡对人体无危害 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
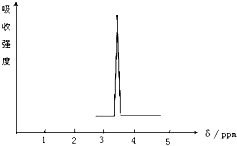 (1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).
(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).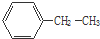 乙苯
乙苯
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 甲 | 乙 | 丙 | |
| 所含元素 | C、H | C、H、F | C、H、F |
| 所含电子数 | 26 | ||
| 结构特点 | 饱和有机物 | ||
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L O3含有分子的数目为NA | |
| B. | 常温常压下,4.0 g CH4中含有共价键的数目为NA | |
| C. | 在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA | |
| D. | 标准状况下,2.24 L Cl2与足量NaOH溶液反应,转移电子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌锰干电池中石墨棒作负极 | |
| B. | 氢氧燃料电池工作时,氢气在负极发生还原反应 | |
| C. | 铅蓄电池放电时,两极质量均增加 | |
| D. | 燃料电池的能量转化率可达100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com