
某溶液仅含下列离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1 mol 。
阳离子:Na+ 、Mg2+ 、Fe3+ 、Al3+ 、Fe2+ ;阴离子:OH—、CO32—、Cl—、NO3—、SO42—。
①若向溶液中加入KSCN溶液无明显变化;
②若向原溶液中加入稀盐酸,有无色气体生成,溶液中阴离子种类不变; 请推断:
(1)原溶液中含有阳离子 含有阴离子
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式
(3)若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体
质量为 g。
(1)Mg2+、Fe2+ (2分) Cl—、NO3—、SO42— (2分)
(2)3Fe2+ +4H+ +NO3—=3Fe3+ +NO↑+2H2O(2分) (3)120 (2分)
解析试题分析:由①可知溶液中不存在Fe3+,由②可知,溶液中可能含有CO32-或Fe2+和NO3-;但如果含有CO32-,阳离子只能存在Na+,由溶液含5种离子,故应存在4种阴离子,由5种离子的物质的量均为1mol,不符合电荷守恒,故溶液中不存在CO32-,应含有Fe2+和NO3-;由于加入盐酸后溶液中阴离子种类不变,故原溶液中应含有Cl-;由5种离子的物质的量均为1mol,故还应含有Mg2+、SO42-才符合电荷守恒。(1)原溶液中含有的阳离子为Mg2+、Fe2+,含有的阴离子为 Cl—、NO3—、SO42—
(2)发生的反应为:3Fe2+ +4H+ +NO3—=3Fe3+ +NO↑+2H2O⑶最后得到的固体为Fe2O30.5mol、MgO1mol,其质量为120g。
考点:考查离子推断、计算等相关知识


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,并设计出相关实验流程图
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有下列物质:① 氢氧化钠固体;② 铜丝;③ 氯化氢气体;④ 稀硫酸;⑤ 二氧化碳气体; ⑥氢氧化钾溶液;⑦ 碳酸钠粉末;⑧ 蔗糖晶体;⑨ 熔融氯化钠,请用序号填空:
(1)上述状态下可导电的是________;(2)属于电解质的是________;(3)属于非电解质的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
⑴按要求写出下列反应的离子方程式
①氢氧化铜溶于盐酸
②碳酸钠溶液中和足量的盐酸溶液混合
(2)现有以下物质:①NaCl晶体 ②液态HCl ③CaCO3固体 ④熔融KCl ⑤蔗糖⑥铜⑦CO2⑧H2SO4⑨KOH固体 ⑩水⑾盐酸⑿CH3COOH ⒀酒精(填序号)
①以上物质中能导电的是_________________________________。
②以上物质中属于电解质的是_____________________________。
③以上物质中属于非电解质的是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某种物质溶于水后得到的溶液中,含有Fe2+、Fe3+、SO42-、NH4+、Ba2+、CO32-离子中的某几种。
(1)甲同学欲探究溶液的组成,进行了如下实验:①取少量溶液于试管中,逐滴加入浓氢氧化钠溶液,发现开始生成白色沉淀,白色沉淀迅速变为灰绿色,最后变为红褐色,同时伴有刺激性气体放出;②另取少量溶液于试管中,加入足量盐酸酸化后再滴加氯化钡溶液,有白色沉淀生成。
该溶液中一定含有的离子是 ;
写出①中白色沉淀转化为红褐色沉淀的化学方程式 。
(2)乙同学进行如下实验:取少量溶液于试管中,滴加几滴硫氰酸钾溶液,无明显现象;再滴加H2O2,发现溶液变红色;继续滴加H2O2,红色逐渐褪去且有气泡产生。为弄清其中缘由,乙同学查阅资料知:
H2O2+SCN-→SO42-+CO2↑+N2↑+H2O+H+
①该反应中,被氧化的元素为 ,每生成lmol CO2转移的电子数为 NA;
②根据乙同学的实验现象,请判断还原性强弱为:Fe2+ SCN-(填<、=或>);
③根据资料,乙同学提出的猜想是:H2O2将SCN-氧化使红色逐渐褪去。请你设计一个实验,验证乙同学的猜想是否正确 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有下列七种物质:
①铝 ②蔗糖 ③CO2 ④H2SO4 ⑤Ba(OH)2 ⑥红褐色的氢氧化铁胶体 ⑦HCl
(1)上述物质中属于电解质的有 。(填序号)
(2)向⑥的溶液中逐渐滴加⑦的溶液,看到的现象是 。
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为:H++OH-=H2O,则该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某透明澄清溶液可能含有Na+、Fe3+、Ba2+、CO32-、SO32-、SO42-、Cl-、I-等离子中的几种,为鉴别这些离子,分别取三份少量溶液,按照以下顺序进行三个实验:
实验①:加CCl4,再滴加少量氯水,振荡后,CCl4后层变为紫色;
实验②:加盐酸后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊;
实验③:加BaCl2溶液产生白色沉淀,过滤出沉淀,在沉淀中加入足量盐酸,沉淀不能完全溶解。
(1)分析上述3个实验,用离子符号写出每一个实验得出的结论,可不必完全填满。
实验①:含有 ;不含 ;
实验②:含有 ;不含 ;
实验③:含有 ;不含 ;
(2)通过上述实验,不能确定是否存在的离子是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。
(1)可利用甲烷催化还原NOx的方法处理NOx,反应如下:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g);△H= -574 kJ·mol-1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g);△H= -1160 kJ·mol-1
则CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g);△H= ;
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图甲所示,则平衡常数K= (小数点后保留3位);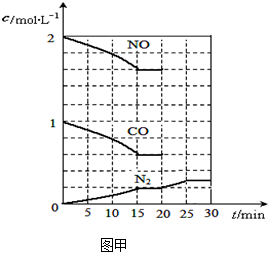
①若保持温度不变,20min时再向容器中充入CO气体0.6mol,平衡将 移动(填“向左”、“向右”或“不”);
②若保持温度不变,20min时向原平衡容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、“向右”或“不”);
③20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是
(填字母);
| A.加入催化剂 | B.降低温度 | C.缩小容器体积 | D.增加CO2的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温常压下,下列10种物质: (1)Na(2)Br2(3)Na2O (4)CO2(5)NH3(6)H2S(7)H2SO4(8)Ba(OH)2(9) AgCl (10)蔗糖
(1)其中属于电解质的是 ;
(2)其中属于非电解质的是 ;
(3)其中能导电的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com