
【题目】电化学原理在生产生活中应用十分广泛.请回答下列问题: 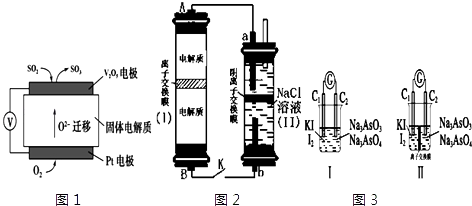
(1)通过SO2传感器可监测大气中SO2的含量,其工作原理如图1所示. ①固体电解质中O2﹣向极移动(填“正”或“负”).
②写出V2O5电极的电极反应式: .
(2)如图2所示装置I是一种可充电电池,装置Ⅱ是一种以石墨为电极的家用环保型消毒液发生器.装置I中离子交换膜只允许Na+通过,充放电的化学方程式为:2Na2S2+NaBr3 ![]() Na2S4+3NaBr ①负极区电解质为:(用化学式表示)
Na2S4+3NaBr ①负极区电解质为:(用化学式表示)
②家用环保型消毒液发生器发生反应的离子方程为 .
③闭合开关K,当有0.04mol Na+通过离子交换膜时,a电极上析出的气体在标准状况下体积为mL.
(3)如图3Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43﹣+2I﹣+2H+AsO33﹣+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸或40%NaOH溶液,电流表指针都不发生偏转;乙组经思考后先添加了一种离子交换膜,然后向图Ⅱ烧杯右侧中逐滴加入适量浓盐酸或适量40%NaOH溶液,发现电流表指针都发生偏转. ①甲组电流表指针都不发生偏转的原因是 .
②乙组添加的是(填“阴”或“阳”)离子交换膜.
【答案】
(1)负; SO2﹣2e﹣+O2﹣=SO3
(2)Na2S2、Na2S4; Cl﹣+H2O ![]() ClO﹣+H2↑;448
ClO﹣+H2↑;448
(3)氧化还原反应在电解质溶液中直接进行,没有电子沿导线通过;阳
【解析】解:(1)①原电池中阴离子移向负极,故答案为:负;
②在V2O5电极上,SO2失电子发生氧化反应生成SO3,电极方程式为:SO2﹣2e﹣+O2﹣=SO3,故答案为:SO2﹣2e﹣+O2﹣=SO3;(2)①原电池的负极发生氧化反应,所含元素化合价升高,所以负极区电解质为:Na2S2、Na2S4,故答案为:Na2S2、Na2S4;
②电解氯化钠溶液生成NaOH、氯气和氢气,氯气与氢氧化钠反应生成次氯酸钠和氯化钠,总反应的离子方程式为Cl﹣+H2O ![]() ClO﹣+H2↑,故答案为:Cl﹣+H2O
ClO﹣+H2↑,故答案为:Cl﹣+H2O ![]() ClO﹣+H2↑;
ClO﹣+H2↑;
③a极生成氯气,b极生成氢气,当有0.04mol Na+通过离子交换膜时,有0.04mol氢离子放电,生成氢气0.02mol,标准状况下体积为:0.02mol×22.4L/mol=0.448L=448mL,故答案为:448;(3)①甲组操作时,两个电极均为碳棒,不发生原电池反应,则微安表(G)指针不发生偏转,故答案为:氧化还原反应在电解质溶液中直接进行,没有电子沿导线通过;
②乙组向图ⅡB烧杯中逐滴加入适量浓盐酸或40%NaOH溶液,发生原电池反应,A中发生I2+2e﹣═2I﹣,为正极反应,而B中As化合价升高,发生氧化反应,添加了阳离子交换膜,故答案为:阳.
(1)①原电池中阴离子移向负极;
②在V2O5电极上,SO2失电子发生氧化反应生成SO3;(2)①原电池的负极发生氧化反应;
②电解氯化钠溶液生成NaOH、氯气和氢气,氯气与氢氧化钠反应生成次氯酸钠和氯化钠;
③a极生成氯气,b极生成氢气,当有0.04mol Na+通过离子交换膜时,有0.04mol氢离子放电;(3)①甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸,发生氧化还原反应,不发生原电池反应;
②乙组向图ⅡB烧杯中逐滴加入适量浓盐酸或40%NaOH溶液,发生原电池反应,A中发生I2+2e﹣═2I﹣,为正极反应,而B中As化合价升高,发生氧化反应,以此分析.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】科学家利用石墨烯和具有粘弹性的聚硅树脂(俗称橡皮泥)制备出一种具有极高 灵敏度的电力学传感材料,能够检测轻微的变形和冲击,其灵敏程度甚至能探测到蜘蛛的运动。该材料可用于制作检测人体脉搏、血压的传感器等。实验室模拟工业合成方法,制备聚硅树脂的中间体氯甲基三乙氧基硅烷ClCH2Si(OEt)3 。量取20mL甲基三氯硅烷(CH3SiCl3)注入三口烧瓶中,开启电磁搅拌加热器升温至66℃,从a中加入浓盐酸,加热A一段时间,待温度升至110℃,停止加热,在三口烧瓶中加入30mL无水乙醇(EtOH),迅速反应生成氯甲基三乙氧基硅烷ClCH2Si(OEt)3,待温度降至室温后,将三口烧瓶中液体转移到蒸馏烧瓶中蒸馏,收集得到174.5℃馏分12mL。
物质 | C2H5OH | CH3SiCl3 | ClCH2SiCl3 | ClCH2Si(OEt)3 |
相对分子质量 | 46 | 149.5 | 184 | 212.5 |
熔点/℃ | -114.1 | -77.8 | — | — |
沸点/℃ | 78.3 | 66.4 | 116.5 | 174 |
密度/g·mL | 0.79 | 1.30 | 1.47 | 1.02 |
已知:甲基三氯硅烷为无色液体,具有刺鼻恶臭,易潮解;氯甲基三乙氧基硅烷易水解,能与碱金属氢氧化物生成碱金属硅醇盐。

(1)连接好装置后,检验装置气密性的操作是:_________________________________;
(2)A装置中发生反应的离子方程式是:_______________________________________;
装置C的作用是:_____________________ ;E中所装液体是:______________;
(3)装置D中发生反应的化学方程式为:① CH3SiCl3 + Cl2 → ClCH2SiCl3 + HCl
②__________________________________________________________________ ;
球形冷凝管的作用是:________________________;
(4)有同学发现该装置有一处不足可能会导致实验失败,应该__________________________________________________;
(5) 该方法制备氯甲基三乙氧基硅烷的产率是:_______________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1gH2和4gO2反应放出71.45kJ热量,则氢气的燃烧热为142.9 kJmol﹣1
B.在稀溶液中,H+(aq)+OH﹣(aq)═H2O(1)△H=﹣57.3 kJmol﹣1 , 若将含0.5molH2SO4的浓硫酸与含1molNaOH的氢氧化钠溶液混合,放出的热量大于57.3kJ
C.HCl和NaOH反应的中和热△H=﹣57.3 kJmol﹣1 , 则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJmol﹣1
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于吸热反应的是( )
A. 炭燃烧生成一氧化碳 B. 中和反应
C. Ba(OH)2·8H2O与NH4Cl反应 D. 锌粒与稀H2SO4反应制取H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示。

请回答下列问题。
(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,写出反应(Ⅲ)的化学方程式:_______________________。
(2)若D为氯碱工业的重要产品,A、B、C 为均含有同一种金属元素的无机化合物,反应(Ⅲ)的离子方程式为________________________。
(3)若B为非金属单质,且B 所含元素的原子最外层电子数与内层电子数之和的比值为3: 5,则反应(Ⅲ)中氧化产物与还原产物的物质的量之比为______,0.1mol A与含0.15molNaOH 的溶液充分反应后,溶液中所含离子浓度的大小关系为______。(已知: 常温下H2S 的电离平衡常数Ka1= 1.3×10-7 Ka2=7.1×10-15)
(4)若A、B、C 的溶液均显碱性,C 为焙制糕点的发酵粉的主要成分之一。
①A中所含化学键类型为________,D的电子式为_________
②25℃时,浓度均为0.1mol/L 的B、C 溶液,pH 较大的是______(填溶质的化学式)溶液,写出B 溶液中显电中性的原因:__________________(用B 溶液中有关粒子的浓度关系表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4·(NH4)2SO4·6H2O。硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了。硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得。下图是模拟工业制备硫酸亚铁铵晶体的实验装置。回答下列问题:

I.(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS 等),再用清水洗净。用氢氧化钠溶液煮沸的目的是__________________。
(2)将处理好的铁屑放入锥形瓶中,加入稀硫酸。锥形瓶中发生反应的离子方程式可能为________(填序号)。
A.Fe+2H+==Fe2++H2↑ B.Fe2O3+5H+===2Fe3++3H2O
C.2Fe3++S2-==2Fe2++S↓ D.2Fe3++Fe==3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞_______,打开活塞______(填字母)。容器③中NaOH溶液的作用是___________;向容器①中通入氢气的目的是___________。
I.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部。在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。制得的硫酸亚铁铵晶体中往往含有极少量的Fe2+。为测定晶体中Fe2+的含量,称取一份质量为20.0g 的硫酸亚铁铵晶体样品,制成溶液。用0.5 mol/LKMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO4- 被还原成Mn2+时,耗KMnO4 溶液体积20.00mL。
滴定时,将KMnO4 溶液装在____(酸式或碱式) 滴定管中,判断反应到达滴定终点的现象为____;晶体中FeSO4的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.酸雨是指pH小于7的降水
B.水泥、玻璃、水晶饰物和珍珠都是硅酸盐制品
C.城市空气质量报告中包括PM2.5、SO2、NO2、CO2等污染物
D.钢是用量最大、用途最广的合金,青铜是我国历史上最早使用的合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是电解饱和食盐水的装置,通电一段时间后下列说法不正确的是

A. 阴极附近溶液的pH增大
B. 阳极产生的气体可用湿润的淀粉碘化钾试纸检验
C. 若阳极最终收集到气体4.48L,则反应中转移电子的物质的量为0.4 mol
D. 完全电解后充分混合U型管中物质,所得溶液会含有NaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度不同压强(P1<P2)下,可逆反应2X(g)2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是( )
A.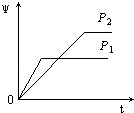
B.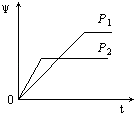
C.
D.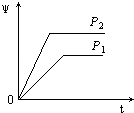
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com