
����Ŀ����1������0.5mol/L��NaOH��Һ������ʱ������ƿ�м�����ˮ�����̶��ߣ����� ��������ƫ��������ƫС����������������
��2����ʯ���з�������͡�ú�ͺͲ��͵ȣ������õķ����� ��������������������������
��3����ȥ������̼�����е��Ȼ������ʣ�ѡ�õ��Լ��� ��������NaOH��Һ����������NaHCO3��Һ����
��4����ͼ��ʵ������ȡ������װ�ã��ش��������⣺
���ռ������ķ����� �ſ�������
����֤�����Ƿ��ռ����ķ����� ����дһ�֣�
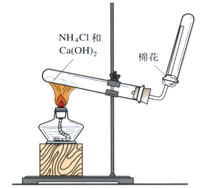
���𰸡���1��ƫС��2������3������NaHCO3��Һ��4����ʪ��ĺ�ɫʯ����ֽ�����������Թܿڣ�����ֽ����ɫ��˵���ռ���
���������⣺��1������0.5mol/L��NaOH��Һ������ʱ������ƿ�м�����ˮ�����̶��ߣ��ᵼ����Һ���ƫ����Ũ��ƫС���ʴ�Ϊ��ƫС��
��2������ʯ���и���ֵķе㲻ͬ��ʯ���з�������͡�ú�ͺͲ��͵ȵIJ���Ϊʯ�͵ķ��ʴ�Ϊ������
��3��CO2��HCl��Ϊ�������壬������NaOH��Һ��Ӧ����CO2�뱥��NaHCO3��Һ����Ӧ����HCl���뱥��NaHCO3��Һ����CO2���ʳ�ȥ������̼�����е��Ȼ������ʣ�ѡ�õ��Լ��DZ���NaHCO3��Һ���ʴ�Ϊ������NaHCO3��Һ��
��4�����������ܶȱȿ�����С���ʲ��������ſ��������ʴ�Ϊ�����£�
��������Ψһ�ļ������壬��ֻҪ��֤���м��������ݳ��������Ѽ������ʷ���Ϊ��ʪ��ĺ�ɫʯ����ֽ�����������Թܿڣ�����ֽ����ɫ��˵���ռ������ʴ�Ϊ����ʪ��ĺ�ɫʯ����ֽ�����������Թܿڣ�����ֽ����ɫ��˵���ռ�����


 ���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��1��������ͼ��ʾ������ж�����˵������ȷ���� ��
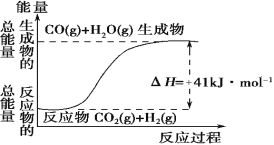
A�����Ȼ�ѧ����ʽΪ��CO(g) + H2O(g)=CO2(g) + H2(g) ��H��41 kJ��mol��1
B���÷�ӦΪ���ȷ�Ӧ
C���÷�ӦΪ���ȷ�Ӧ
D������H2OΪҺ̬ʱ��Ӧ��Ϊ��H2������H2����H
��2��25����101 kPa�£���֪1g������ȫȼ������Һ̬ˮʱ�ų�142.9 kJ����������ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ�� ��
��3����֪��Ӧ��N2(g) + O2 (g) �� 2NO(g) ��H1
2H2(g) + O2(g) �� 2H2O(g) ��H2
N2(g) + 3H2(g) �� 2NH3(g) ��H3
��������������Ӧ������4NH3(g) + 5O2(g) �� 4NO(g) + 6H2O(g) ��H4 �ķ�Ӧ�ʱ�Ϊ (�ú���H1����H2����H3��ʽ�ӱ�ʾ)��
��4���⼰�仯�����ںϳ�ɱ������ҩ��ȷ�����й㷺��;���ش��������⣺
�������ĵ⸻���ں����У���ˮ��ȡ��Ũ��������Ũ��Һ�м�MnO2��H2SO4�����ɵõ�I2���÷�Ӧ�Ļ�ԭ����Ϊ ��
����֪��Ӧ2HI��g��![]() H2��g�� + I2��g������H= + 11kJmol��1��1molH2��g����1molI2��g�������л�ѧ������ʱ�ֱ���Ҫ����436KJ��151KJ����������1molHI��g�������л�ѧ������ʱ�����յ�����Ϊ kJ��
H2��g�� + I2��g������H= + 11kJmol��1��1molH2��g����1molI2��g�������л�ѧ������ʱ�ֱ���Ҫ����436KJ��151KJ����������1molHI��g�������л�ѧ������ʱ�����յ�����Ϊ kJ��
��Bodensteins�о������з�Ӧ��2HI��g��![]() H2��g�� + I2��g��
H2��g�� + I2��g��
��716Kʱ�����������е⻯������ʵ�������x��HI���뷴Ӧʱ��t�Ĺ�ϵ�����
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
X��HI�� | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
X��HI�� | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
��������ʵ�������÷�Ӧ��ƽ�ⳣ��K�ļ���ʽΪ�� ��������Ӧ�У�����Ӧ����Ϊv��=k��x2��HI�����淴Ӧ����Ϊv��=k��x��H2��x��I2��������k����k��Ϊ���ʳ�������k��Ϊ ����K��k����ʾ������k��=0.0027min��1����t=40minʱ��v��= min��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������Ȼ�̼��Һ��Ӧ����CHBr2CBr2CH2CH3 �� ���������ͬ����ͬ���칹���ǣ� ��
A.CH��CCH2CH3
B.CH3C��CCH3
C.CH3CH2CH2CH3
D.CH2=CHCH=CH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ�У���д��ȷ������ ��
A�����ˮ�еμ�FeCl3��Һ�Ʊ�Fe(OH)3���壺Fe3����3 H2O![]() Fe(OH)3����3 H��
Fe(OH)3����3 H��
B������ʯ��ˮ��ϡ���ᷴӦCa(OH)2 + 2 H+ �T Ca2+ + 2 H2O
C��ϡ������������Fe2O3 + 6 H+ == 2 Fe3+ + 3 H2O
D�������Ba(OH)2��Ӧ�� Ba2+ + OH�� + SO42�� + H+ = BaSO4�� + H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCl3��Һ�е���KSCN��Һ��Ѫ��ɫ������Ϊ���������з�Ӧ��FeCl3+3KSCNFe(SCN)3+3KCl�����ƽ����ϵ�м�������KCl���壬��ɫ��( )
A.��dz
B.����
C.����
D.��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ��Ӧ���ʵ�˵���У�������ȷ���ǣ� ��
A����������ӿ��˷�Ӧ���ʣ��ı��˷�Ӧ���ջ�ų�������
B������ij���淴Ӧ����Ӧ���еľ������������淴Ӧ����֮��
C������Ӧ����Խ��Ӧ���ת����Խ��
D��ѹǿԽ����Ӱٷ���Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����14������չ�ྻú����������CO2�Ʊ������Դ�ȶ���ʵ�ּ�̼�ŷŵ���Ҫ;����
��1����úת����ˮú���ķ�Ӧ��C��s����H2O��g��![]() CO��g����H2��g������Ч�����Դ�����ʣ�����������Ӧ��ϵ�м�������������������ֲ��������˷�Ӧ�ġ�H________�����������С�����䡱�����жϵ�������________��
CO��g����H2��g������Ч�����Դ�����ʣ�����������Ӧ��ϵ�м�������������������ֲ��������˷�Ӧ�ġ�H________�����������С�����䡱�����жϵ�������________��
��2��CO2�Ʊ��״���CO2��g����3H2��g��![]() CH3OH��g����H2O��g����H��-49.0kJ��mol-1�������Ϊ1L���ܱ������У�����1molCO2��3molH2�����CO2��g����CH3OH��g��Ũ����ʱ��仯����ͼ��ʾ��
CH3OH��g����H2O��g����H��-49.0kJ��mol-1�������Ϊ1L���ܱ������У�����1molCO2��3molH2�����CO2��g����CH3OH��g��Ũ����ʱ��仯����ͼ��ʾ��
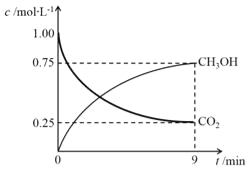
�ٸ÷�Ӧ��ѧƽ�ⳣ��K�ı���ʽ��________��
��0~9minʱ���ڣ��÷�Ӧ��ƽ����Ӧ���ʦ���H2��=________��
������ͬ�����£��ܱ������������С��0.5Lʱ���˷�Ӧ��ƽ��ʱ�ų���������Q��������________������ĸ�����kJ��
a.0<Q<29.5
B��29.5<Q<36.75
C��36.75<Q<49
D��49<Q<98
����һ�������£���ϵ��CO2��ƽ��ת������������L��X�Ĺ�ϵ����ͼ��ʾ��L��X�ֱ��ʾ�¶Ȼ�ѹǿ��
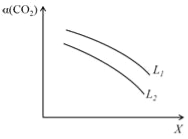
X��ʾ���������ǡ��ж�L1��L2�Ĵ�С��ϵ��
��3����ѧ���õ����ز�����ͭ��װ����ͼ���˹����ϵͳ��������װ�óɹ���ʵ������CO2��H2O�ϳ�CH4��
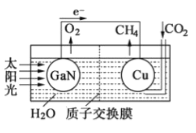
д��ͭ�缫����ĵ缫��Ӧʽ��Ϊ��߸��˹����ϵͳ�Ĺ���Ч�ʣ�����װ���м���������ѡ����ᡱ�����ᡱ����
��4������CO2��NH3Ϊԭ��Ҳ�ϳ����أ��ںϳ����е���Ҫ��Ӧ�ɱ�ʾ���£�
��Ӧ��:2NH3��g��+CO2��g��=NH2CO2NH4��s����H1=__________________
��Ӧ��:NH2CO2NH4��s��=CO��NH2��2��s��+H2O��g����H2=+72.49kJ��mol-1
�ܷ�Ӧ:2NH3��g��+CO2��g��=CO��NH2��2��s��+H2O��g����H=-86.98kJ��mol-1;
��Ӧ�ٵġ�H1=_______________��
��5���ֽ�amol����bmolͭ�Ļ�����뺬��cmolHNO3��ϡ��Һ��ַ�Ӧ���軹ԭ����ΪNO�����н��۲���ȷ�������������
A����ʣ�����0.5amol������������Ϊһ�ֻ����
B����ֻ��һ�����������3c=8a
C�����ж��������������ԭ���������ʵ���Ϊ0.25cmol
D���������������������ԭ���������ʵ���Ϊ0.25cmol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���й��Ŵ��Ĵ���֮һ�ĺڻ�ҩ����������ǡ�ľ̿�ۺ���ʯ��ɣ�������������������ʮ���ձ飬��Ӱ�����ǽ�����ʳƷ��ȫ���������������䷽��̼�����ƣ�С�մͳ�����ɡ����й�����ʯ�ͳ��۵ijɷ������ȷ����
A.KNO3��NH4HCO3
B. KNO3��Na2CO3
C. HNO3��(NH4)2CO3
D.NH4NO3��Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ�������MMA���Ǿۼ���ϩ��������л��������ĵ��壬Ҳ��������������֬�����ϡ�Ϳ�ϡ�ճ�ϼ������ȣ�MMA�ĺϳ�·����ͼ��ʾ����Ӧ�������Լ��ԣ���
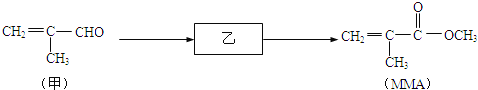
��ش�
��1�����������������ŵ������� ��
��2��MMA�ķ���ʽ�� ��
��3���ҵĽṹ��ʽ�� ��
��4��MMA��һ�����������ɾۼ���ϩ������Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com