
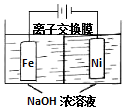
 具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-$\frac{\underline{\;通电\;}}{\;}$FeO42-+3H2↑,其工作原理如图所示.下列叙述正确的是( )
具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-$\frac{\underline{\;通电\;}}{\;}$FeO42-+3H2↑,其工作原理如图所示.下列叙述正确的是( )| A. | 电解一段时间后,阳极室的c(OH-)增大 | |
| B. | Na+由阴极室移向阳极室 | |
| C. | 阴极反应式:2H2O+2e-=H2↑+2OH- | |
| D. | 电解过程中,当消耗1 mol OH-时,同时生成33.6 L H2 |
分析 由Fe+2H2O+2OH-$\frac{\underline{\;通电\;}}{\;}$FeO42-+3H2↑可知,电解时阳极上Fe失去电子,阴极上发生2H2O+2e-=H2↑+2OH-,阳离子向阴极移动,结合电解反应计算.
解答 解:A.镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,离子交换膜应阻止溶液中的氢氧根离子向阳极移动,防止生成氢氧化亚铁,因此电解一段时间后,阳极室c(OH-)降低,故A错误;
B.Na+由离子交换膜从阳极室移向阴极室,故B错误;
C.阴极上H得到电子,发生2H2O+2e-=H2↑+2OH-,故C正确;
D.电解过程中,当消耗1 mol OH-时,同时生成1.5mol氢气,但Vm未知,不能计算其体积,故D错误;
故选C.
点评 本题考查电解原理,为高频考点,把握电解反应及电极反应为解答本题的关键,侧重分析与应用能力的考查,注意离子交换膜只允许阳离子透过,题目难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
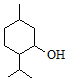
| A. | 薄荷醇分子式为C10H20O,它是环己醇的同系物 | |
| B. | 薄荷醇的分子中至少有12个原子处于同一平面上 | |
| C. | 薄荷醇在Cu或Ag做催化剂、加热条件下能被O2氧化为醛 | |
| D. | 在一定条件下,薄荷醇能发生取代反应、消去反应和聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上,采用电解MgCl2溶液的方法制取金属镁 | |
| B. | 利用太阳能等淸洁能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 硬币材质一般都是合金,所有的不锈钢中都含有非金属元素 | |
| D. | 使用含钙、镁离子浓度较大的地下水洗衣服,肥皂去污能力会减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 漂白粉的成分为次氯酸钙和氯化钙 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| D. | 浓硫酸具有强氧化性,所以浓硫酸可用于干燥H2和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将2 mol NO和2 mol O2混合,充分反应后体系中原子总数为8NA | |
| B. | 将100 mL 0.1 mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA | |
| C. | CO2通过Na2O2使其增重a g时,反应中转移的电子数为$\frac{a}{56}$NA | |
| D. | 100 g质量分数为9.8%的H2SO4水溶液中含氧原子数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
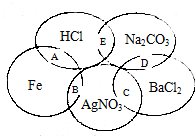 如图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应.请回答下列问题:
如图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④>①=②>③ | B. | ①>④>②>③ | C. | ④>①>③>② | D. | ④>②>①>③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com