
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:填空题
(本题共12分)TiCl4是一种重要的化工原料,其工业生产过程如下:
2FeTiO3(s) + 7Cl2(g) + 6C (s) 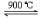 2TiCl4 (g) + 2FeCl3(g) + 6CO(g) – Q (Q>0)
2TiCl4 (g) + 2FeCl3(g) + 6CO(g) – Q (Q>0)
回答下列问题:
1.该反应达到平衡后,若使正反应速率增大可采取的方法有_________。(选填编号)
a.加压 b.加入碳 c.升温 d.及时移走CO
2.若上述反应在固定体积的密闭容器中发生,一定能说明反应已达平衡的是_______。(选填编号)
a. 反应物不再转化为生成物
b. 炉内FeTiO3与TiCl4 的质量比保持不变
c. 反应的热效应不再改变
d. 单位时间内,n(FeTiO3)消耗:n(FeCl3)生成=1:1
3.上述反应中所有非金属元素原子的半径从大到小的顺序为_____________;其中不属于同周期又不属于相邻族的两元素形成_____分子(填“极性”或“非极性”),通过比较____________可以判断这两种元素的非金属性。
4.上述反应中,非金属性最弱的元素原子的电子共占据_______个原子轨道,最外层电子排布式为____________。它形成的固态单质中只含一种强烈的相互作用力,则该单质属于______晶体。
5.为方便获得氯气,工业制TiCl4厂可以和氯碱厂进行联合生产。CO可合成甲醇,若不考虑损失,上述联合生产在充分利用各种副产品的前提下,合成192 kg甲醇,至少需补充H2 mol。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高三下学期第三次质检考试理综化学试卷(解析版) 题型:简答题
(13分)1902年德国化学家哈博研究出合成氨的方法,其反应原理为:
N2(g)+3H2(g)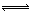 2NH3(g); △H(△H<0)
2NH3(g); △H(△H<0)
一种工业合成氨的简易流程图如下:
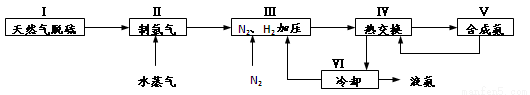
完成下列填空:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生。NH4HS的电子式是___________,写出再生反应的化学方程式:__________________。NH3的沸点高于H2S,是因为NH3分子之间存在着一种比_________力更强的作用力。
(2)室温下,0.1 mol/L的氯化铵溶液和0.1 mol/L的硫酸氢铵溶液,酸性更强的是_______,其原因是___________________________________________________________。
已知:H2SO4:H2SO4 = H++HSO4-;
HSO4-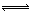 H++SO42- :
H++SO42- :
K =1.2×10-2 NH3·H2O:K=1.8×10-5
(3)图甲表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:______(保留3位有效数字)。
(4)依据温度对合成氨反应的影响,在图乙坐标系中,画出一定条件下的密闭容器内,从常温下通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。


(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。
简述本流程中提高合成氨原料总转化率的方法(只答一种即可):_________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省岳阳市高三质量检测(二)理综化学试卷(解析版) 题型:选择题
下列解释实验事实的方程式正确的是
A.硫酸亚铁在空气中被氧化:4Fe2++3O2+6H2O=4Fe(OH)3
B.向CH2Br-COOH中加入足量的氢氧化钠溶液并加热:CH2Br-COOH+OH- CH2Br-COO-+ H2O
CH2Br-COO-+ H2O
C.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2 +2H2O = 2Fe2+ + SO42-+ 4H+
D.碳酸钠溶液滴入酚酞变红:CO32-+ 2H2O  H2CO3 + 2OH-
H2CO3 + 2OH-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三学业水平模拟考试化学试卷(解析版) 题型:填空题
(8分)下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答下列问题。
族 周期 | ⅠA | 0 | |||||||
1 | H | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ⑤ | Ne | |||||||
3 | ① | ② | ③ | ④ | ⑥ |
(1)元素④的符号是 ;
(2)⑤和⑥两种元素原子半径的大小关系:⑤ ⑥(填“>”或“<”);
(3)①和②两种元素金属性强弱关系:① ②(填“>”或“<”);
(4)①的最高价氧化物的水化物与元素③的单质反应的化学方程式为: _ ________ _______。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三学业水平模拟考试化学试卷(解析版) 题型:选择题
下列实验方法能达到实验目的的是
A.用淀粉溶液检验溶液中是否存在碘单质
B.用分液漏斗分离水与乙醇的混合物
C.用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液
D.用排水集气法收集氨气
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三学业水平模拟考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.钠和冷水反应: Na + H2O = Na++OH一+H2↑
B.铁粉投入到硫酸铜溶液中:Fe+Cu2+ =Fe2++Cu
C.AlCl3溶液中加入足量的氨水:Al3++3OH一= Al(OH)3↓
D.氯化亚铁溶液中通入氯气:Fe2+ + Cl2=Fe3+ + 2Cl一
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省湛江市高三普通高考测试(二)理综化学试卷(解析版) 题型:选择题
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO3溶于水后能导电 | SO3为电解质 |
B | 铁比铜活泼 | 铜板上的铁钉在潮湿空气中容易生锈 |
C | 浓H2SO4有强氧化性 | 浓H2SO4常温下能与Cu发生反应 |
D | 小苏打可做焙制糕点的膨松剂 | NaHCO3能与碱反应 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市第三次诊断化学试卷(解析版) 题型:简答题
(16分)工业上硫酸锰铵[(NH4)2Mn(SO4)2]可用于木材防火涂料等。其制备工艺如下: 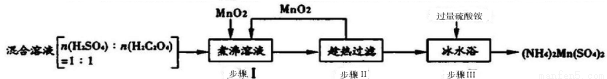
已知步骤Ⅰ反应:H2C2O4(aq) +H2SO4(aq) +MnO2(s) MnSO4(aq)+2CO2(g)+2H2O(1) △H
MnSO4(aq)+2CO2(g)+2H2O(1) △H
(1)在步骤I的反应中,氧化剂是 。
(2)步骤Ⅱ中趁热过滤前需向MnSO4溶液中加入少量热水,其目的是____;步骤III所得(NH4)2Mn(SO4)2:晶体需用酒精溶液洗涤,洗去的主要杂质离子有____ 。
(3)下列操作有利于提高产品产率的是____(填序号)。
A.慢慢分次加入二氧化锰 B.趁热过滤
C.冰水浴充分冷却 D.用水代替酒精溶液洗涤
(4)一定条件下,在步骤I的水溶液中l mol MnO2完全反应相相对能量变化如图。则△H=____;催化剂是否参加化学反应? (填“是”或“否”或“不确定”)。

(5)碱性干电池中含大量MnO2可以回收利用,该电池工作时的正极反应式为____ ;若从干电池中回收87 kg MnO2,理论上可以获得(NH4)2Mn( S04)2 _kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com