
【题目】将反应2Fe3++Cu=2Fe2++Cu2+ 设计成如图所示原电池,可供选择的电解质溶液有FeCl3、CuSO4两种溶液。
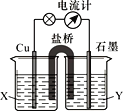
(1)石墨是电池的________极,X应选________溶液,Y应选___________________溶液。
(2)正极上的电极反应式是_________。
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这个碳原子被称为“手性碳原子”,凡含有手性碳原子的物质一定具有光学活性,如物质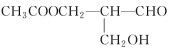 有光学活性,发生下列反应后生成的有机物无光学活性的是( )
有光学活性,发生下列反应后生成的有机物无光学活性的是( )
①与甲酸发生酯化反应 ②与NaOH溶液反应 ③与银氨溶液作用 ④在催化剂存在下与氢气作用
A. ①③B. ②④
C. ①④D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的氮循环如图所示,下列说法不正确的是
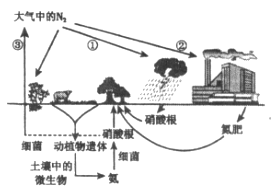
A. 氧元素参与了氮循环
B. ②中合成氨属于人工固氮
C. ①和③中氮元素均被氧化
D. 含氮有机物和含氮无机物可相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适合的条件,将反应Fe3++AgFe2++Ag+设计成如下图所示的原电池(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后,观察到电流计指针向右偏转。下列判断不正确的是

A. 在外电路中,电子从银电极流向石墨电极
B. 盐桥中的K+移向甲烧杯
C. 一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转
D. 电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋酸钠(NaBiO3)是分析化学中的重要试剂,在水中缓慢分解,遇沸水或酸则迅速分解。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:
Ⅰ.制取铋酸钠
制取装置如图(加热和夹持仪器已略去),部分物质性质如下:

(1)C中盛放Bi(OH)3与NaOH的混合物,与Cl2反应生成NaBiO3,反应的化学方程式为__。B装置的作用是__。
(2)当观察到__(填现象)时,可以初步判断C中反应已经完成。
(3)拆除装置前必须先除去残留的Cl2,以免污染空气。除去烧瓶A中残留Cl2的操作是:关闭__;打开__。
(4)反应结束后,为从装置C中获得尽可能多的产品,需要的操作有_。
Ⅱ.铋酸钠的应用——检验Mn2+
(5)往待检液中加入铋酸钠晶体,加硫酸酸化,生成Bi3+,且溶液变为紫红色,证明待检液中存在Mn2+。产生紫红色现象的离子方程式为__。
Ⅲ.产品纯度的测定
(6)取上述NaBiO3产品ag,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用bmo1L-1的H2C2O4标准溶液滴定生成的MnO4-(已知:H2C2O4+MnO4-—CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗cmL标准溶液。该产品的纯度为__(用含a、b、c的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,浓度均为1mol·L-1的两种气体X2和Y2,在恒容密闭容器中发生可逆反应生成气体Z,充分反应后X2的浓度为0.4mol·L-1,Y2的浓度为0.8mol·L-1,生成的Z的浓度为0.4mol·L-1,则该反应的化学方程式(Z用X、Y表示)是
A.X2+2Y2![]() 2XY2B.2X2+Y2
2XY2B.2X2+Y2![]() 2X2Y
2X2Y
C.X2+3Y2![]() 2XY3D.3X2+Y2
2XY3D.3X2+Y2![]() 2X3Y
2X3Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿比朵尔结构简式如图,它对体外的冠状病毒有抑制作用,有关说法正确的是( )
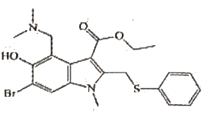
A.该物质化学式为C22H25BrN2O3S,分子中含有3个苯环结构
B.该物质存在多种官能团,如羟基、酯键、溴原子和甲基
C.一定条件下,该物质在NaOH溶液中能发生水解反应,产物有乙醇和溴化钠等
D.该物质能与溴水发生加成反应,也能与溴水发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HF分子在一定条件下会发生二聚反应:2HF(g)(HF)2(g)。经实验测得,不同压强下,体系的平均相对分子质量(M=![]() )随温度(T)的变化曲线如图所示,下列说法正确的是( )
)随温度(T)的变化曲线如图所示,下列说法正确的是( )
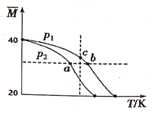
A.该反应的ΔH>0B.气体的压强:p(a)>p(b)=p(c)
C.平衡常数:K(a)=K(b)<K(c)D.测定HF的相对分子质量要在低压、高温条件下
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬和氢气在工业上都有重要的用途。已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4)。铜铬构成原电池如图所示,盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是
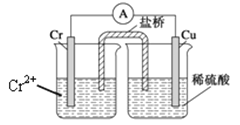
A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液
B.理论上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池
C.此过程中H+得电子,发生氧化反应
D.电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com