
【题目】常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A.  <1.0×10-7mo1/L
<1.0×10-7mo1/L
B. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. c(H+)+c(NH4+)>c(OH-)+c(HCO3-)+2c(CO32-)
D. c(Cl-)>c(HCO3-)>c(NH4+)>c(CO32-)
【答案】A
【解析】试题分析:A.Kw=c(H+)×c(OH-)=1.0×10-14,已知pH<7,即c(H+)>1.0×10-7mol/L,则KW/ c(H+)<1.0×10-7mol/L,故A正确;B.溶液中存在物料守恒即c(Na)=c(C),所以c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故B正确;C.溶液中存在电荷守恒:c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),由于析出部分NaHCO3晶体,则c(Na+)<c(Cl-),所以c(H+)+c(NH4+)>c(OH-)+c(HCO3-)+2c(CO32-),故C正确;D.铵根离子部分水解,则c(Cl-)>c(NH4+),由于析出部分NaHCO3晶体,则HCO3-浓度减小,HCO3-的电离程度很小,所以c(CO32-)最小,即c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-),故D错误,故选D。
考点:考查混合溶液中离子浓度的计算、离子浓度大小比较、电荷守恒和物料守恒的应用。
【题型】单选题
【结束】
21
【题目】关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:
观点一是:“理论派”认为电解氯化铜溶液后溶液的pH 升高。
观点二是:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH的变化如下图曲线的关系。
pH与时间关系图

请回答下列问题:
(1)电解前氯化铜溶液的pH处在A 点位置的原因是______________________(用离子方程式说明)。
(2)“理论派”所持观点的理论依据是________________________。
(3) “实验派”实验结论是_________________。他们所述“精确实验”是通过______________确定的。
(4)若“实验派”的观点正确,那么你认为他们所持观点的理由是______________________(用化学方程式和必要的文字加以简述)。
【答案】 Cu2++2H2O![]() Cu(OH)2+2H+ 因为Cu2++2e-→Cu,使Cu2+水解平衡向左移动,c(H+)减小,pH上升 pH降低 测定溶液pH CuCl2
Cu(OH)2+2H+ 因为Cu2++2e-→Cu,使Cu2+水解平衡向左移动,c(H+)减小,pH上升 pH降低 测定溶液pH CuCl2![]() Cu+Cl2↑ Cl2+H2O=HCl+HClO,使溶液酸性增强,pH降低
Cu+Cl2↑ Cl2+H2O=HCl+HClO,使溶液酸性增强,pH降低
【解析】本题主要考查平衡状态的移动。
(1)电解前氯化铜溶液的pH处在A点位置的原因是Cu2++2H2O![]() Cu(OH)2+2H+。
Cu(OH)2+2H+。
(2)“理论派”所持观点的理论依据是因为Cu2++2e-=Cu,c(Cu2+)减小,使Cu2+水解平衡向左移动,c(H+)减小,pH上升。
(3)“实验派”实验结论是pH降低。他们所述“精确实验”是通过测定溶液pH确定的。
(4)若“实验派”的观点正确,那么他们所持观点的理由是CuCl2![]() Cu+Cl2↑、Cl2+H2O=HCl+HClO,使溶液酸性增强,pH降低。
Cu+Cl2↑、Cl2+H2O=HCl+HClO,使溶液酸性增强,pH降低。


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.1 mol![]() 的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
(1)有人称溶液①是油污的“清道夫”,原因是_____________________(用离子方程式解释)
(2)这四种溶液中水的电离程度由大到小的顺序是(用序号填写)______________________
(3)向④中加入少量氯化铵固体,此时![]() 的值___________(填“增大”“减小”或“不变”)。
的值___________(填“增大”“减小”或“不变”)。
(4)等体积混合③和④的溶液,此时溶液中[NH4+]+[NH3·H2O]=_____________mol·L-1(填数值);此时溶液中离子浓度的大小顺序是:__________________________;若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积_________④的体积(填“大于”小于”或“等于”)
(5)将10 mL溶液③加水稀释至100 mL,则此时溶液中由水电离出的c( H+)=___________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2SO4是一种常见的化肥,某工厂用石膏、NH3、H2O和CO2制备(NH4)2SO4的工艺流程如下:

下列说法正确的是
A. 通入NH3和CO2的顺序可以互换
B. 操作2为将滤液加热浓缩、冷却结晶、过滤,可得(NH4)2SO4
C. 步骤②中反应的离子方程式为Ca2++2NH3+CO2+H2O=CaCO3↓+2NH4+
D. 通入的NH2和CO2均应过量,且工艺流程中CO2可循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是合成抗生素灰黄霉素的中间产物,其合成路线如下:

已知:
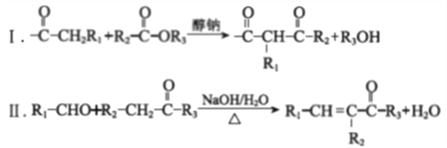
(R1、R2、R3代表烃基或氢原子)
(1)A中含有的官能团的名称为醚键、氯原子、________、________。
(2)A→C反应的化学方程式是________。
(3)C→D的反应类型是________。
(4)E的结构简式是________。
(5)I的核磁共振氢谱中只有一个吸收峰。
①条件a是________。
②H→I反应的化学方程式是________。
③I→K反应的化学方程式是________。
(6)L的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应H2+Cl2![]() 2HCl,下列说法正确的是
2HCl,下列说法正确的是
A.该反应涉及到离子键和共价键的断裂与形成
B.该反应中,化学能只转变为热能
C.断开1molH﹣H键和1molCl﹣Cl键所吸收的总能量,小于形成1molH﹣Cl键所放出的能量
D.反应物所具有的总能量高于产物所具有的总能量
[
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子晶体:
①HCl ②HBr ③HI ④CO ⑤N2 ⑥H2
熔沸点由高到低的顺序是
A.①②③④⑤⑥ B.③②①⑤④⑥ C.③②①④⑤⑥ D.⑥⑤④③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向![]() 镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体
镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体![]() 。向反应后的溶液中加入
。向反应后的溶液中加入![]() 氢氧化钠溶液
氢氧化钠溶液![]() ,使金属离子刚好沉淀完全,得到的沉淀质量为
,使金属离子刚好沉淀完全,得到的沉淀质量为![]() 。再将得到的沉淀灼烧至质量不再改变为止。得到固体
。再将得到的沉淀灼烧至质量不再改变为止。得到固体![]() 。则下列关系不正确的是
。则下列关系不正确的是
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分类不正确的是( )
A.纯碱、烧碱均属于碱类
B.CO2、SiO2、SO2均属于酸性氧化物
C.醋酸、硫酸、硝酸均属于酸类
D.Na2CO3、Na2SO3、NaCl均属于钠盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com