
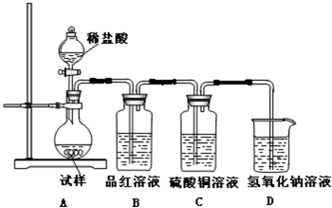
| ||
| ||


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Br->Fe2+>I- |
| B、I->Fe2+>Br- |
| C、Br->I->Fe2+ |
| D、Fe2+>I->Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 仪器代号 | 所装试剂 | 装置作用 |
| A | 石灰石和 | 制取CO2证明硝酸比碳酸强 |
| C | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验操作 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温. |
| Ⅱ | 取少量实验步骤Ⅰ所得固体放于一洁净的试管中,用足量的稀硫酸溶解. |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红. |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
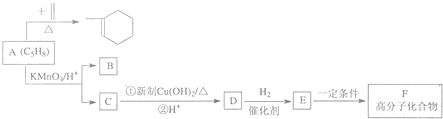
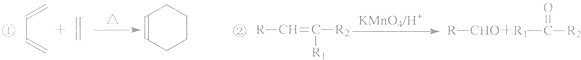
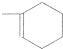 时,A发生的反应类型为
时,A发生的反应类型为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、接触法制硫酸:氧化炉、硫铁矿、V2O5、400℃-500℃ |
| B、联合制碱法制纯碱:吸氨塔、碳酸塔、食盐、二氧化碳、氨、30℃-35℃的氨化饱和食盐水吸收二氧化碳 |
| C、合成氨:沸腾炉、焦炭、铁触媒、500℃ |
| D、氨氧化法制硝酸:合成塔、空气、铂铑合金、800℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com