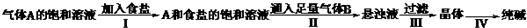(2013?闵行区一模)氯化硫酰(SO
2Cl
2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO
2(g)+Cl
2(g)
SO
2Cl
2(l)+97.3kJ
(1)试写出常温常压下化学平衡常数K的表达式:K=
;
若在此条件下,将化学平衡常数K增大,化学反应速率v
正也增大,可采取的措施是
d
d
(选填编号).
a.降低温度 b.移走SO
2Cl
2c.增加反应物浓度 d.无法满足上述条件
(2)为了提高上述反应中Cl
2的平衡转化率,下列措施合理的是
ac
ac
(选填编号).
a.缩小容器体积 b.使用催化剂 c.增加SO
2浓度 d.升高温度
(3)在100℃时,往上述平衡体系中加入
37Cl
2,一段时间后,则平衡体系中含有
37Cl的物质有
c
c
(选填编号).
a.只有
37Cl
2 b.只有SO
237Cl
2 c.
37Cl
2和SO
237Cl
2 d.无法判断
(4)下列描述中能说明上述反应已达平衡的是
bd
bd
(选填编号).
a.υ(Cl
2)=υ(SO
2) b.容器中气体压强不随时间而变化
c.c(Cl
2):c(SO
2)=1:1 d.容器中气体颜色不随时间两变化
(5)300℃时,体积为1L的密闭容器中充入16.20g SO
2Cl
2,达到平衡时容器中含SO
2 7.616g.若在上述中的平衡体系中,再加入16.20g SO
2Cl
2,当再次达平衡时,容器中含SO
2的质量范围是
7.616g<m(SO2)<15.232g
7.616g<m(SO2)<15.232g
.



 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案