
资料显示:在一定条件下黄铵铁钒在pH=0.5~2.5范围内均能稳定存在,工业上用酸浸法制取硫酸铜的流程示意图如下:
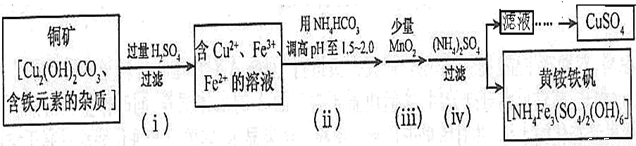
根据题意完成下列问题:
(1)步骤(ii)所加试剂起调节pH作用的离子是 (填离子符号)。
(2)在步骤(iii)发生的反应中,加入少量MnO2的作用是
(3)步骤(iv)除去杂质的离子方程式可表示为
(4)实验室模拟碱式碳酸铜[Cu2(OH)2CO3]的制备,向大试管中加入碳酸钠溶液和硫酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。根据上述碱式碳酸铜的制备方法,请完成以下问题:
①过滤后洗涤的目的是什么 ;简述如何洗涤沉淀
②若实验得到a g样品(只含CuO杂质),取此样品加热至分解完全后,得到b g固体,此样品中碱式碳酸铜的质量分数是
(14分)
(1)HCO3-(2分)
(2)将溶液中Fe2+转变为Fe3+ (2分)
(3)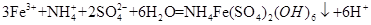 (3分)
(3分)
(4)①除去沉淀表面吸附的Na+ 和SO42-(2分);沿着玻璃棒向漏斗中加蒸馏水至刚好浸没沉淀,让蒸馏水流尽后,重复2~3次即可。(2分)
②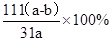 (3分)
(3分)
【解析】
试题分析:
(1)流程图中可以看出铜矿在过量硫酸的作用下溶解,溶液呈强酸性,NH4HCO3中HCO3-+H+=CO2+H2O;
(2)根据工艺流程图中可以看出黄铵铁钒中为Fe3+,在ⅱ、ⅲ、ⅳ中一定有氧化剂,故MnO2将溶液中Fe2+转变为Fe3+;
(3)从ⅳ溶液离子和产物分析得到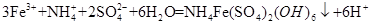 ;
;
(4)结合题中信息,①洗涤的目的是除去沉淀表面吸附的Na+ 和SO42-。
②设Cu2(OH)2CO3质量为Xg,
Cu2(OH)2CO3 2CuO+CO2↑+H2O↑,由差量法可得
2CuO+CO2↑+H2O↑,由差量法可得
222g △m=62g
Xg (a-b)g
Xg=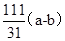 g,此样品中碱式碳酸铜的质量分数是
g,此样品中碱式碳酸铜的质量分数是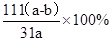 。
。
考点:本题以工艺流程为基础,考查元素及化合物、化学实验基本操作等相关知识。


科目:高中化学 来源: 题型:阅读理解
| 1 |
| 10000 |
| 1 |
| 10000 |
查看答案和解析>>
科目:高中化学 来源: 题型:
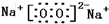
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:






 和
和
 和
和




查看答案和解析>>
科目:高中化学 来源: 题型:
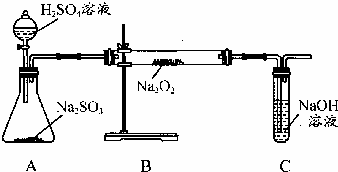 某化学学习小组的同学为探究过氧化钠与二氧化硫的反应,用如图所示的装置进行实验.通入足量的气体后将带火星的木条插入试管C中木条复燃.请回答下列问题
某化学学习小组的同学为探究过氧化钠与二氧化硫的反应,用如图所示的装置进行实验.通入足量的气体后将带火星的木条插入试管C中木条复燃.请回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com