
【题目】A、B、C分别代表中学化学中常见物质,请根据题目要求回答下列问题:
(1)实验室常用A的饱和溶液制备微粒直径为lnm-100nm的红褐色液相分散系,则该反应的化学方程式为:_____,将A的溶液加热蒸干并灼烧,得到固体的化学式为:_____。
(2)B为地壳中含量最高的金属元素的氯化物,向50.0mL,6mol/L的B溶液中逐滴滴入100mL某浓度的KOH溶液,若产生7.8g白色沉淀,则加入的KOH溶液的浓度可能为____。
(3)将A、B中两种金属元素的单质用导线连接,插入一个盛有KOH溶液的烧杯中构成原电池,则负极发生的电极反应为:_______。
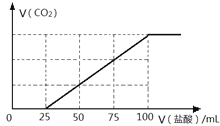
(4)C是常见温室气体,将一定量的气体C通入100mL 某浓度的KOH得溶液F,向F溶液中逐滴加入2 molL-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。则F溶质与足量石灰水发生反应最多可得沉淀的质量为____g。
(5)pH = 3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液。若溶液的pH偏高,则碱式硫酸铝产率降低且有气体C产生,用化学方程式表示其原因_____。
【答案】FeCl3+3H2O![]() Fe(OH)3(胶体)+3HClFe2O33mol/L或11mol/LAl-3e-+4OH-=AlO2-+2H2O0.53CaCO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CaSO4↓+3CO2↑
Fe(OH)3(胶体)+3HClFe2O33mol/L或11mol/LAl-3e-+4OH-=AlO2-+2H2O0.53CaCO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CaSO4↓+3CO2↑
【解析】
(1)红褐色液相分散系是Fe(OH)3胶体,则A的饱和溶液是氯化铁饱和溶液,FeCl3饱和溶液在加热条件下水解生成氢氧化铁胶体,化学方程式为FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl,HCl具有挥发性,加热促进HCl挥发,从而促进FeCl3水解,蒸干时得到固体Fe(OH)3,灼烧Fe(OH)3得到Fe2O3,化学反应方程式为2Fe(OH)3
Fe(OH)3(胶体)+3HCl,HCl具有挥发性,加热促进HCl挥发,从而促进FeCl3水解,蒸干时得到固体Fe(OH)3,灼烧Fe(OH)3得到Fe2O3,化学反应方程式为2Fe(OH)3 ![]() Fe2O3+3H2O,所以最终得到的固体是Fe2O3,故答案为:FeCl3+3H2O
Fe2O3+3H2O,所以最终得到的固体是Fe2O3,故答案为:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl; Fe2O3;
Fe(OH)3(胶体)+3HCl; Fe2O3;
(2)地壳中含量最高的金属元素是Al,则B为AlCl3,氢氧化铝沉淀的质量是7.8g,其物质的量为![]() =0.1mol,溶液中含有的铝离子为0.050L×6mol/L=0.3mol。
=0.1mol,溶液中含有的铝离子为0.050L×6mol/L=0.3mol。
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,KOH的物质的量为0.1mol×3=0.3mol,
其物质的量浓度为![]() =3mol/L;
=3mol/L;
②碱与铝离子的物质的量之比大于3:1,小于4:1,
则由Al3+ + 3OH- ═ Al(OH)3↓
0.3mol 0.9mol 0.3mol
Al(OH)3 + OH-═AlO2-+2H2O
(0.3-0.1)mol 0.2mol
则消耗的碱的物质的量为0.9mol+0.2mol=1.1mol,其物质的量浓度为![]() =11mol/L;故答案为:3mol/L或11mol/L;
=11mol/L;故答案为:3mol/L或11mol/L;
(3)Al-Fe-KOH溶液原电池中,Al和氢氧化钠溶液能发生反应,Fe和氢氧化钠溶液不反应,因此Al为负极,Fe为正极,负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O,故答案为:Al-3e-+4OH-=AlO2-+2H2O;
(4)C是常见温室气体,C为CO2,。由曲线可知从25mL到100mL为碳酸氢钾与盐酸反应生成二氧化碳,反应方程式为KHCO3+HCl=KCl+CO2↑+H2O,所以n(CO2)=n(HCl)=(0.1L-0.025L)×0.2mol/L=0.015mol;K2CO3转化为KHCO3消耗盐酸为25mL,生成的KHCO3转化为二氧化碳又可以消耗盐酸25mL,故KOH与CO2气体反应所得F溶液中的KHCO3消耗盐酸的体积为75mL-25mL=50mL,故K2CO3、KHCO3的物质的量之比为25mL:50mL=1:2,即F溶液中含有0.005mol的K2CO3和0.01mol的KHCO3。0.005mol的K2CO3与足量石灰水发生反应最多生成0.005mol碳酸钙沉淀,质量为0.005mol ×100g/mol=0.5g,故答案为:0.5;
(5)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,若溶液的pH偏高,溶液碱性增强,铝离子与碳酸根离子双水解生成氢氧化铝和二氧化碳,反应的化学方程式为3CaCO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CaSO4↓+3CO2↑,故答案为:3CaCO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CaO4↓+3CO2↑。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】目前,人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,能使有毒气体转化为无毒气体:4CO(g)+2N02(g)![]() C02(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是_____填字母);
C02(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是_____填字母);
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C. 2v逆(NO2)=v正(N2)
D.容器内混合气体密度保持不变
(2)用活性炭还原法也可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g)△H。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
浓度/mol·L-1 | ||||||
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析Tl℃时,该反应在0~20 min的平均反应速率v(C02)=___;计算该反应的平衡常数K=____。(保留两位有效数字)
②根据上表数据判断,由30 min到40 min时改变的条件可能是(任写一种)_____。
(3)以CO2span>与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式____。
(4)科学家利用原电池原理,在酸性溶液中将N02转化为HN03,则该转化的负极电极方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 将100mL0.1molL-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
B. 常温常压下,4.6 g C2H6O所含碳氢共价键数为0.6 NA
C. 2gD216O中含有的质子数、中子数,电子数均为NA
D. 向FeI2溶液中通入适量Cl2,当有lmolFe2+被氧化时,共转移的电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是
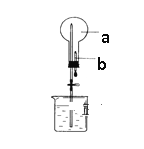
A. a为Cl2气体,b为饱和NaCl溶液
B. a为NH3气体,b为盐酸溶液
C. a为CO2气体,b为浓NaOH溶液
D. a为HCl气体,b为H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量Fe2O3和Al2O3的混合固体溶解在200mL 0.1mol·L-1的过量H2SO4溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100 mL,则NaOH溶液的浓度为
A. 0.4 mol·L-1 B. 0.2 mol·L-1
C. 0.1 mol·L-1 D. 0.8 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,11.2LNO和11.2LO2混合后气体的分子总数为NA
B. 标准状况下,由H2O2制得4.48LO2转移的电子数目为0.8NA
C. 14g由乙烯与环丙烷组成的混合气体含有的碳原子数目为NA
D. 25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量的铝铁合金与100mL很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4 mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
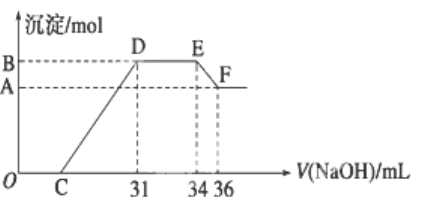
(1)结合OH-的能力最弱的是________(填离子符号)
(2)B与A的差值为________mol.
(3)原混合物中铝粉与铁粉的物质的量之比为______.
(4)B点对应的沉淀量为________mol,C点对应的溶液体积为________mL.
(5)硝酸溶液的物质的量浓度为_________mol·L-1
(6)写出铝与该浓度硝酸反应的离子方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸铜的方法很多:
(1)方法一:用浓硫酸和铜制取硫酸铜。该反应的化学方程式是_______________________。
(2)方法二:实验证明,铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的。铜屑在此状态下被溶解的化学方程式为_____________________________。
(3)以上两种方法________(填“前”或“后”)者好,原因是________________________。
(4)方法三:用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:
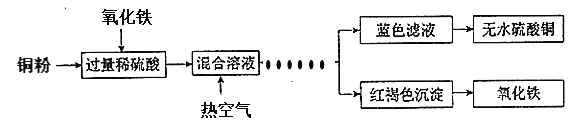
稀硫酸和氧化铁反应的离子方程式是_____________________________(反应①);铜和上述反应(反应①)得到的物质反应的离子方程式是_________________________;向混合溶液中通入热空气的目的是_______________________________;分离蓝色滤液和红褐色沉淀的实验操作是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有HCl和AlCl3的混合溶液中加入NaOH溶液,生成的沉淀和加入NaOH溶液的体积关系的大致图像为
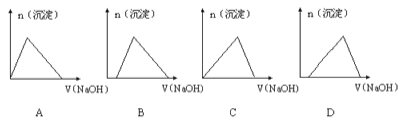
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com