
从下列事实所列出的相应结论正确的是
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| D | 常温下白磷可自燃,而氮气须在放电时才与氧 气反应 | 非金属性:P>N |
【知识点】电解质定义、元素非金属性比较D2 E2
【答案解析】C 解析:A、Cl2的水溶液可以导电是因为生成的盐酸和次氯酸电离,而Cl2不是电解质也不是非电解质,故A错误;B、SO2通入硝酸钡溶液出现白色沉淀为BaSO4,故B错误;C、NaHCO3溶液与NaAlO2溶液混合产生白色沉淀是因为AlO2-得到质子,结合H+的能力:CO32-<AlO2-故C正确;D、常温下白磷可自燃,而氮气须在放电时才与氧气反应,不能说明氮、磷的非金属性强弱,硝酸比磷酸酸性强,说明非金属性:N>P,故D错误。
故答案选C
【思路点拨】本题考查了电解质定义、元素非金属性比较等问题,要理解元素非金属性比较的方法。


科目:高中化学 来源: 题型:
下列各组离子能在指定环境中大量共存的是( )
A.在c(HCO3-)=0.1 mol·L-1的溶液中:NH4+、AlO2-、Cl-、NO3-
B.在由水电离出的c(H+)=1×10-12 mol·L-1的溶液中:Fe2+、ClO-、Na+、SO42-
C.在加入铝粉产生H2的溶液中:SO42-、NO3-、Na+、NH4+
D.在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要
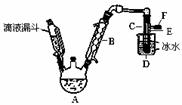 加热,图中省去了加热装置。有关数据见表:
加热,图中省去了加热装置。有关数据见表:
表.乙醇、溴乙烷、溴有关参数
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
⑴ 制备操作中,加入的浓硫酸必需进行稀释,其目的是 (选填序号)。
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.减少HBr的挥发d.水是反应的催化剂
⑵ 已知加热温度较低时NaBr与硫酸反应生成NaHSO4,写出加热时A中发生的主要反应
的化学方程式 。
⑶ 仪器B的名称 ,冷却水应从B的 (填“上”或“下”)口流进。
⑷ 反应生成的溴乙烷应在 中(填“A”或“C”中)。
⑸ 若用浓的硫酸进行实验时,得到的溴乙烷呈棕黄色,最好选择下列 (选填序号)
溶液来洗涤产品。
a.氢氧化钠 b.亚硫酸钠 c.碘化亚铁 d.碳酸氢钠
洗涤产品时所需要的玻璃仪器有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
充分燃烧某糖,消耗的O2、生成的CO2和H2O的物质的量都相等,它的相对分子质量是它最简式式量的6倍,0.1 mol 该糖能还原银氨溶液生成21.6 g银,0.1 mol该糖能与30 g乙酸发生酯化反应。求该糖的:
(1)最简式。
(2)相对分子质量、分子式。
(3)若该糖是直链分子,已知同一个碳原子上连有2个—OH不稳定,试推导其结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的2倍。下列说法不正确的是( )
A.X的氢化物溶液与其最高价氧化物对应的水化物溶液的酸碱性相反
B.Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料
C.X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸
D.Z的氢化物比X的氢化物更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上非金属元素中所形成的最简单气态氢化物稳定性最弱的是(填化学式) ;E、F、L、I所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(2)由L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为 。固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式 。
(3)在10 L的密闭容器中,通入2 mol LD2气体和1 mol D2气体,一定温度下反应后生成LD3气体,当反应达到平衡时,D2的浓度为0.01 mol·L-1,同时放出约177 KJ的热量,则平衡时LD2的转化率为 ;该反应的热化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素A、B、C、D、E的原子序数依次增大,其中只有C是金属元素,B是地壳中含量最多的元素,A元素常见化合价为+1和-1;A与C的最外层电子数相同,C、D两元素原子的电子数之和为A、B两种元素原子的电子数之和的3倍。下列叙述正确的是
A.元素的原子半径:A<B<C< D< E ( )
B.对应氢化物的热稳定性:D > E
C.B与C、B与D形成的化合物中化学键类型相同
D.五种元素中最高价氧化物对应的水化物酸性最强的是E
查看答案和解析>>
科目:高中化学 来源: 题型:
苯丙酸诺龙是一种兴奋剂,结构简式如右图所示,有关苯丙酸诺龙的说法不正确的是( )
A.含有两种官能团 B.含有脂环
C.是一种芳香化合物 D.含有酯基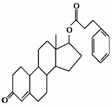
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上研究燃料脱硫的过程中,涉及如下反应:
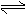 CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g),K1,△H1= 218.4 kJ·mol-l(反应I)
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g),K1,△H1= 218.4 kJ·mol-l(反应I)

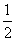 CaSO4(s)+2CO(g)
CaSO4(s)+2CO(g) 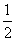 CaS(s)+2CO2(g),K2,△H2= -87.8 kJ·mol-l(反应II)
CaS(s)+2CO2(g),K2,△H2= -87.8 kJ·mol-l(反应II)
 (1)反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)的△H= ;平衡常数K= (用K1,K2表示)。
(1)反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)的△H= ;平衡常数K= (用K1,K2表示)。
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:

前100 s 内v(SO2)= mo1·L-1·s-l,平衡时CO的转化率为 。
(3)若只研究反应II,在不同条件下其反应能量变化如下图所示:图中曲线a到曲线b的措施是________,恒温恒容时,下列说法能说明反应Ⅱ到达平衡状态的是____ 。
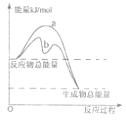
A.体系中气体的平均摩尔质量不再改变
B.v(CO)=v(CO2)
C.CO的转化率达到了最大限度
D.体系内气体压强不再发生变化
(4)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量[用n(CO)表示]对CaO(s)+3CO(g)+SO2(g)
 CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
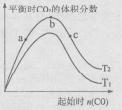
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是____ 。
②图像中T2 T1(填“高于”、“低于”、“等于”或“无法确定”):判断的理由是____ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com