
| A. | 气体F不能与溶液E发生反应 | |
| B. | X中肯定存在Fe2+、Al3+、NH4+、SO42- | |
| C. | X中肯定不存在CO32-、SO32-、Cl- | |
| D. | X中不能确定的离子是Al3+和Cl- |
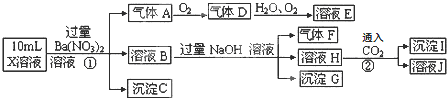
分析 强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子;溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子;
H中通入二氧化碳生成了沉淀I,I可能为氢氧化铝或在碳酸钡,故溶液中不一定含有铝离子;不能确定是否含有的离子是Cl-,以此解答.
解答 解:强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子;溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子;
H中通入二氧化碳生成了沉淀I,I可能为氢氧化铝或在碳酸钡,故溶液中不一定含有铝离子;不能确定是否含有的离子是Cl-,
A.溶液E为HNO3,气体F为NH3,二者能反应生成硝酸铵,故A错误;
B.X中肯定存在Fe2+、NH4+、SO42ˉ,不能肯定是否存在A13+,故B错误;
C.溶液X中一定不存在:CO32-和SO32-,可能存在:C1-,故C错误;
D.通过以上分析知,X中不能确定的离子是 A13+和C1ˉ,故D正确.
故选D.
点评 本题考查无机物推断,为高频考点,明确常见物质性质及状态是解本题关键,注意NO的特殊性质是推断A的关键,注意:亚硫酸盐能被硝酸氧化,题目难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
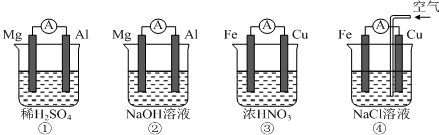
| A. | ①中Mg作负极,电子流向:Mg→稀硫酸→Al | |
| B. | ②中Al作负极,OH?迁移方向:Al→外电路→Mg | |
| C. | ③中Fe作正极,电极反应式:2H++2e?═H2↑ | |
| D. | ④中Cu作正极,电极反应式:O2+4e?+2H2O═4OH? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:钠>硫>氯 | |
| B. | 最高价氧化物对应的水化物的酸性:HClO4>H2SO4>H3PO4 | |
| C. | 热稳定性:碘化氢>溴化氢>氯化氢 | |
| D. | 最高正化合价:氯>硫>磷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| C. | 侯氏制碱法的最终产品是小苏打 | |
| D. | 明矾可用于水的杀菌、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
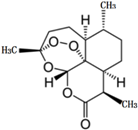 2015年10月,屠呦呦因青蒿素和双氢青蒿素的贡献,荣获2015年诺贝尔生理学或医学奖,成为第一位获得诺贝尔科学奖项的中国本土科学家.青蒿素的化学结构如图所示,下列说法不正确的是( )
2015年10月,屠呦呦因青蒿素和双氢青蒿素的贡献,荣获2015年诺贝尔生理学或医学奖,成为第一位获得诺贝尔科学奖项的中国本土科学家.青蒿素的化学结构如图所示,下列说法不正确的是( )| A. | 青蒿素的分子式为C15H21O5 | |
| B. | 由青蒿素分子中所含官能团推测,该物质难溶于水 | |
| C. | 在碱性条件下,青蒿素易发生水解反应 | |
| D. | 青蒿素因具有特殊的过氧基团,易受热和还原性物质的影响而分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
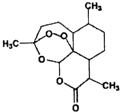 屠呦呦等科学家用乙醚从青蒿中提取出青蒿素,其结构如图所示,已知结构中含有与H2O2相似的过氧键.下列说法正确的是( )
屠呦呦等科学家用乙醚从青蒿中提取出青蒿素,其结构如图所示,已知结构中含有与H2O2相似的过氧键.下列说法正确的是( )| A. | 青蒿素的结构中含有过氧键受热容易分解 | |
| B. | 乙醚的结构简式为:CH3OCH3 | |
| C. | 青蒿素溶于热水,所以应加热加快溶解 | |
| D. | 乙醚易溶于水,不能用分液的方法分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.40 mol | B. | 0.20 mol | ||
| C. | 小于0.20mol | D. | 大于0.20 mol,小于0.40 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com