
| A. | 常温下,由水电离出的c(H+)=10-12mol/L,则溶液pH一定为12 | |
| B. | 已知H2C2O4是弱酸,其电离方程式为:H2C2O4?2H++C2O42- | |
| C. | 常温下,pH=10的氨水溶液中,由水电离出的c(H+)=10-10mol/L | |
| D. | 工业合成氨温度控制在500℃,目的是为了提高产率 |
分析 A、水存在电离平衡H2O?H++OH-,纯水中水电离的氢离子浓度为:c(H+)=1×10-7mol/L,水电离出的c(H+)=1×10-11 mol/L<1×10-7mol/L,说明抑制了水的电离,该溶液可能为酸和碱;
B、已知H2C2O4是弱酸,其电离应该是分步进行的;
C、常温下,pH=10的氨水溶液中,水的电离受到抑制,根据Kw=c(H+)•c(OH-)来计算回答;
D、工业合成氨得反应是给放热的,升高温度,可以提高产量,据此回答.
解答 解:A、水电离出的c(H+)=1×10-12 mol/L<1×10-7mol/L,说明抑制了水的电离,该溶液可能为酸性或者碱性溶液,若为酸性溶液,溶液中氢氧根离子是水电离的,溶液中氢氧根浓度=水电离出的氢离子浓度为:1×10-12 mol/L,溶液的pH=2;若为碱性溶液,则溶液中氢离子是水电离的,溶液的pH为12,故A错误;
B、H2C2O4是二元弱酸,其电离应该是分2步进行的,故B错误;
C、常温下,pH=10的氨水溶液中,水的电离受到抑制,根据Kw=c(H+)•c(OH-),由水电离出的c(H+)=10-10mol/L,故C正确;
D、工业合成氨得反应是给放热的,升高温度,可以提高产量,但是工业合成氨温度控制在500℃,是考虑催化剂的催化活性,故D错误.
故选C.
点评 本题重点考查了水的电离及其影响因素,题目难度中等,注意掌握影响水的电离的因素,明确酸或者碱抑制了水的电离,能够水解的盐促进了水的电离.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:解答题
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
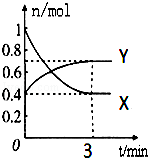 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验装置 | 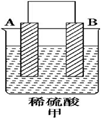 |  | 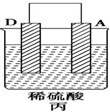 |
| 部分实验现象 | A(二价金属)不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
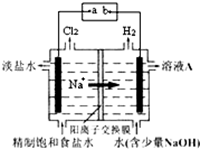 氯碱工业中电解饱和食盐水的原理示意图如图所示.
氯碱工业中电解饱和食盐水的原理示意图如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 短周期主族元素原子的最外层电子数都等于元素的最高化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | 同周期第ⅡA族与第ⅢA族的元素原子序数之差不一定为1 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuS不溶于弱酸,能溶于强酸 | |
| B. | CuS不溶于非氧化性酸,能溶于氧化性酸 | |
| C. | CuS溶于硝酸,是因为硝酸氧化性强于硫酸,S2-被氧化,使CuS溶解 | |
| D. | CuS溶于硝酸,是因为硝酸的酸性大于硫酸和盐酸的酸性,S2-结合H+,放出H2S气体,使CuS溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com