
【题目】高岭土主要由高岭石![]() 长期风化而成,其中还含有一定量的白云石
长期风化而成,其中还含有一定量的白云石![]() ,高岭土是制作陶瓷的原料。完成下列填空:
,高岭土是制作陶瓷的原料。完成下列填空:
(1)矿石中除![]() 外的三种非金属元素的原子半径从小到大的顺序是______。硅原子的核外电子排布式是___,镁原子核外有_________种能量不同的电子。
外的三种非金属元素的原子半径从小到大的顺序是______。硅原子的核外电子排布式是___,镁原子核外有_________种能量不同的电子。
(2)判断![]() 的金属性强于
的金属性强于![]() 的事实是____________。
的事实是____________。
a. ![]() 的碱性强于
的碱性强于![]()
b. ![]() 微溶于水,
微溶于水,![]() 难溶于水
难溶于水
c. 与热水反应,钙比镁剧烈
d. 单质钙保存在煤油里,单质镁不需要
(3)![]() 和
和![]() 同是ⅣA族元素的氧化物,
同是ⅣA族元素的氧化物,![]() 的熔点明显比
的熔点明显比![]() 高的原因是________。
高的原因是________。
(4)氮化硅(![]() )是一种新型陶瓷材料,制备反应如下:
)是一种新型陶瓷材料,制备反应如下:![]() ,该反应的平衡常数表达式___________;反应达到平衡后,若增大
,该反应的平衡常数表达式___________;反应达到平衡后,若增大![]() 浓度,则
浓度,则![]() 值____________(填“增大”“减小”或“不变”)。
值____________(填“增大”“减小”或“不变”)。
【答案】![]()
![]()
![]()
![]() 4 ac
4 ac ![]() 属于分子晶体,熔沸点由范德华力决定,
属于分子晶体,熔沸点由范德华力决定,![]() 是原子晶体,熔沸点由共价键决定,因为共价键大于范德华力,故
是原子晶体,熔沸点由共价键决定,因为共价键大于范德华力,故![]() 熔沸点高。
熔沸点高。  不变
不变
【解析】
(1)矿石中除![]() 外的三种非金属元素是Si、O、C,三者的原子半径O<C<Si。硅原子的核外电子排布式是
外的三种非金属元素是Si、O、C,三者的原子半径O<C<Si。硅原子的核外电子排布式是![]() ;镁原子核外电子排布式为1s22s22p63s2,有4种不同的轨道,所以有4种能量不同的电子。
;镁原子核外电子排布式为1s22s22p63s2,有4种不同的轨道,所以有4种能量不同的电子。
(2)a. 碱性越强,金属性越强,![]() 的碱性强于
的碱性强于![]() ,所以钙的金属性强于镁,正确;
,所以钙的金属性强于镁,正确;
b. 虽然![]() 微溶于水,
微溶于水,![]() 难溶于水,但溶解性与碱性强弱无关,错误;
难溶于水,但溶解性与碱性强弱无关,错误;
c. 与热水反应,金属性越强,与热水反应越剧烈,钙比镁剧烈,所以金属性钙比镁强,正确;
d. 单质钙保存在煤油里,隔绝空气,防止被氧化;单质镁不需要,不是因为不活泼,而是因为生成的MgO致密,阻止内部金属的进一步反应,所以不能由存放方式判断金属的活动性强弱,错误。
故选ac。
(3)![]() 和
和![]() 同是ⅣA族元素的氧化物,
同是ⅣA族元素的氧化物,![]() 的熔点明显比
的熔点明显比![]() 高的原因是
高的原因是![]() 属于分子晶体,熔沸点由范德华力决定,
属于分子晶体,熔沸点由范德华力决定,![]() 是原子晶体,熔沸点由共价键决定,因为共价键大于范德华力,故
是原子晶体,熔沸点由共价键决定,因为共价键大于范德华力,故![]() 熔沸点高。
熔沸点高。
(4)反应![]() 中,SiO2、C、Si3N4为固体,不能出现在平衡常数表达式中,该反应的平衡常数表达式
中,SiO2、C、Si3N4为固体,不能出现在平衡常数表达式中,该反应的平衡常数表达式 。反应达到平衡后,若增大
。反应达到平衡后,若增大![]() 浓度,虽然平衡右移,但由于温度不变,所以
浓度,虽然平衡右移,但由于温度不变,所以![]() 值不变。
值不变。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 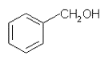 与
与![]() 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物
B.  属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C. ![]() 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D. ![]() 的名称为:2-甲基-1,3-二丁烯
的名称为:2-甲基-1,3-二丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值下列有关说法中正确的是( )
A.常温常压下,46gN2O4中含氧原子数为2NA
B.常温常压下,11.2LNH3中含共价键的数目为1.5NA
C.电解精炼铜阳极质量减少32g时电路中转移电子总数为NA
D.1L0.2mol/LNa2SO4溶液中含有阴阳离子总数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一无色透明的溶液做如下实验:
①取少量溶液滴加盐酸酸化的BaCl2溶液有白色沉淀生成。
②另取部分溶液加入Na2O2,有无色无味气体放出且有白色沉淀生成,加入Na2O2的量与生成沉淀的量的关系如图所示,试问:

(1)Cu2+、NH4+、Al3+、Mg2+、Na+、Fe3+、K+、SO42-等离子中一定存在的离子是__;可能存在的离子是__;一定不存在的离子是___。
(2)上述溶液至少由___等物质混合成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用63%的浓HNO3(其密度为1.4g/mL)配制240mL0.50mol/L稀HNO3,若实验仪器有:A.10mL量筒 B.50mL量筒 C.托盘天平 D.玻璃棒 E.100mL容量瓶 F.250mL容量瓶 G.500mL容量瓶 H.胶头滴管 I.200mL烧杯。
(1)此浓硝酸的物质的量浓度为___mol/L。
(2)应量取63%的浓硝酸___mL,应选用的量筒是___(填仪器的字母编号)。
(3)实验时还需选用的仪器有(填序号)D、I、___(填序号)
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是___(填序号)。
①量取浓硝酸的量筒用蒸馏水洗涤2﹣3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③定容时俯视刻度线
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计的微型实验装置验证SO2的性质,通过分析实验,下列结论表达正确的是( )
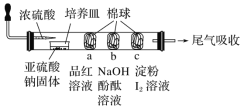
A.a棉球褪色,验证SO2具有氧化性
B.c棉球蓝色褪去,验证SO2漂白性
C.b棉球褪色,验证SO2具有酸性氧化物的通性
D.可以使用浓硫酸吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究氨基甲酸铵(NH2COONH4)分解的化学平衡和水解反应速率。
(1)将一定量纯净的氨基甲酸铵置于固定容积为 100mL 的密闭真空溶液 A 中,在恒定温度下使其达到分解 平衡。实验测得不同温度下的平衡数据列于下表:
温度(℃) | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总物质的量(mol) | 0.34 | 0.48 | 0.68 | 0.94 |
①氨基甲酸铵分解的化学方程式为 NH2COONH4(s) 2NH3(g)+CO2(g),若 25.0℃时达到平衡所用时间为8min,根据数据计算 NH3 的平均生成速率为__________。
②可以判断该分解反应已经达到化学平衡的是_____。
A. 2v(NH3)正=v(CO2)逆
B.密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D. 密闭容器中氨气的体积分数不变
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵 溶液测定水解反应速率,得到 c(NH2COO-)随时间变化趋势如图所示。根据图中信息,如何说明水解反应速率随温度升高而增大:_____。

(3)合成氨工业对国民经济和社会发展具有重要意义。工业合成氨常用的催化剂是_____,氨分子的电子式是_____。
(4)如图是一定的温度和压强下时 N2 和 H2 反应生成 1molNH3 过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:__________________________。(热量 Q 的数值使用含字母 a、b 的代数式表示)

(5)在催化剂存在下,NH3 可用来消除 NO 的污染,生成两种对环境无害的物质。写出反应的化学方程式:_____________________;该反应中氧化产物与还原产物的物质的量之比是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可以发生以下反应:2N2O5(g) ![]() 4NO2(g)+O2(g) △H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见表:
4NO2(g)+O2(g) △H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见表:
![]()
下列说法中不正确的是
A.500s内N2O5分解速率为2.96×10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1 >T2,则K1>K2
D.平衡后,其他条件不变,将容器体积压缩到原来的![]() ,则c(NO2)<5.00mol·L-1
,则c(NO2)<5.00mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com