
下列实验事实得出的结论不正确的是
选项 | 实验事实 | 结论 |
A | H2可在Cl2中燃烧 | 燃烧不一定有氧气参加 |
B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 氧化铝熔点高于铝 |
C | 将SO2通入含HClO的溶液中,生成H2SO4 | HClO酸性比H2SO4强 |
D | 向FeCl2溶液中滴入KSCN溶液,在液面出现微红色 | Fe2+在空气中被氧化 |
C
【解析】
试题分析:A、燃烧广义定义是任何发光发热剧烈的反应,氢气在氯气中产生苍白色的火焰,因此燃烧不一定有氧气参加,说法正确;B、铝箔加热过程中发生4Al+3O2 2Al2O3,熔化而不滴落,说明Al2O3的熔点高于Al,保护内部铝不被氧化,说法正确;C、SO2+HClO+H2O=HCl+H2SO4,利用的是HClO具有强氧化性,SO2具有还原性,发生氧化还原反应,而不是酸性强的制取弱酸,说法不正确;D、FeCl2露置在空气中发生:4Fe2++O2+4H+=4Fe3++2H2O,Fe3+与KSCN生成血红色溶液,而Fe2+与KSCN不反应,说法正确。
2Al2O3,熔化而不滴落,说明Al2O3的熔点高于Al,保护内部铝不被氧化,说法正确;C、SO2+HClO+H2O=HCl+H2SO4,利用的是HClO具有强氧化性,SO2具有还原性,发生氧化还原反应,而不是酸性强的制取弱酸,说法不正确;D、FeCl2露置在空气中发生:4Fe2++O2+4H+=4Fe3++2H2O,Fe3+与KSCN生成血红色溶液,而Fe2+与KSCN不反应,说法正确。
考点:考查元素及其化合物的性质。


科目:高中化学 来源:2014-2015福建省龙岩市非一级达标校高一上学期期末化学试卷(解析版) 题型:选择题
用铝箔包装0.1mol金属钠,用针扎出一些小孔,放入水中,完全反应后,用排水取气法收集产生的气体,则收集到的气体为(标准状况)
A.O2和H2的混合气体 B.1.12LH2
C.大于1.12LH2 D.小于1.12LH2
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市丰台区高一上学期期末考试化学试卷(解析版) 题型:选择题
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市丰台区高一上学期期末考试化学试卷(解析版) 题型:选择题
下列溶液中,常温下可以用铁罐装运的是
A.浓盐酸 B.稀硝酸 C.浓硫酸 D.硫酸铜
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市朝阳区高一上学期期末考试化学试卷(解析版) 题型:填空题
下图为氮及其化合物的类别与化合价对应的关系图。

(1)实验室制取氨气。
① 化学方程式是 。
② 可用向下排空气法收集氨气的原因是 。
③ 用水吸收多余的氨气时,如将导管直接插入水中,
会产生倒吸现象,产生该现象的原因是 。
(2)完成下列能生成NO的化学方程式:
① 体现N元素的还原性:
a. 汽车尾气中产生的NO:N2 + O2  2NO。
2NO。
b. 氨的催化氧化:_________。
② 体现N元素的氧化性:_________。
(3)NO2 易溶于水。将体积为V mL的试管充满NO2后倒扣在水中,见下图。

① NO2溶于水的化学方程式是_________。
② 使试管中NO2完全被水吸收的操作是________。
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市朝阳区高一上学期期末考试化学试卷(解析版) 题型:选择题
用下图所示装置进行下列实验,实验结果与预测的现象不一致的是

①中的物质 | ②中的物质 | 预测①的现象 | |
A | 酚酞溶液 | 浓盐酸 | 无明显变化 |
B | 浓硫酸 | 浓氨水 | 冒白烟 |
C | 酚酞溶液 | 浓氨水 | 溶液变红 |
D | 氯化铝溶液 | 浓氨水 | 出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市朝阳区高一上学期期末考试化学试卷(解析版) 题型:选择题
下列说法中,不正确的是
A.常温下可用铁制容器盛装浓硝酸 B.氧化铁常用作红色油漆和涂料
C.硅胶常用作食品、药品干燥剂 D.生石灰可用作食品的抗氧化剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:填空题
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
湿法 | 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示:
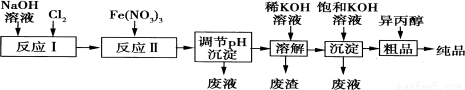
①反应I的化学方程式为 。
②反应Ⅱ的离子方程式为 。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整pH= 时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2 (填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:选择题
有些物质的制备从化学性质的“强制弱”来看似乎难以进行,但利用勒夏特列原理却取得了成功,以下属于这种情况的是
A.NaBr(s)+H3PO4(浓) NaH2PO4(aq)+ HBr(g)
NaH2PO4(aq)+ HBr(g)
B.6CaO(l)+2Al(l) 3CaOAl2O3(s) +3Ca(g)
3CaOAl2O3(s) +3Ca(g)
C.CaCO3(s) +2HCl(aq) →CaCl2(aq) +H2O (l) +CO2(g)
D.KICl2(aq)+H2S(aq)→KI (aq)+2HCl (aq) +S(s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com