
(10分)已知A、B、C、D、E是短周期的5种元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出B、D元素的名称:B ,D 。
(2)画出C元素的离子结构示意图 。
(3)写出D的单质与C的最高价氧化物对应水化物之间反应的离子方程式
(4)A、B、C三种元素形成的化合物所含的化学键类型为 。
(5)B、C、D三种元素的离子半径由大到小的排列顺序为 (用离子符号表示)。
(1)B:氧、 D:铝(各1分) (2) 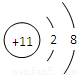 (2分)
(2分)
(3)2A1 + 2OH- + 2H2O = 2AlO2 - + 3H2↑(2分)
(4)离子键、共价键(各1分) (5)O2->Na+ > Al3+ (2分)
【解析】考查元素周期表的结构、原子核外电子的排布规律及元素周期律的应用。A元素原子形成的离子核外电子数为零,所以A是氢元素。E的单质为黄色晶体,易溶于二硫化碳,则E是单质硫。B与E同主族,所以B是氧元素。C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应,因此一定有铝元素。A与C同主族,且C的原子序数等于氧元素的,所以C是钠元素,则D是铝元素。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以B、C、D三种元素的离子半径由大到小的排列顺序为O2->Na+ > Al3+。


科目:高中化学 来源: 题型:
(分)已知A、B、C、D、E五种元素都是元素周期表中前20号元素,原子序数依次增大,E的特征电子排布式为4s2。A、B、C、D四种元素在元素周期表中的相对位置如下表所示。
| …… | A | ||||||
| B | C | D |
根据以上信息,回答下列问题:
(1)元素C在元素周期表中的位置是 周期 族;D的电子排布式为: 。
(2)A和D的氢化物中,沸点较高的是 ,原因是
;A和B的离子中,半径较小的是 (填离子符号)。
 (3) A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如右图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是 。
(3) A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如右图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是 。
(4)A和E化合物的晶胞1/8的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算(结果保留一位小数):_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(每空1分,共10分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 ;另一种只由B组成的离子与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)D单质晶体堆积为____________________。用●表示D原子,在方框内画出其晶胞图。
查看答案和解析>>
科目:高中化学 来源:2013届山西省高二下学期第一次月考化学试卷(解析版) 题型:填空题
(每空1分,共10分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 ;另一种只由B组成的离子与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)D单质晶体堆积为____________________。用●表示D原子,在方框内画出其晶胞图。

查看答案和解析>>
科目:高中化学 来源:2014届江苏省高一第一学期期中考试化学试卷 题型:填空题
(本小题满分10分)已知A 是一种相对分子质量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。已知B、D是厨房常用调味剂。

请回答下列问题:
(1)写出A的结构简式 。
(2)B、D分子中的官能团名称分别是 、 。
(3)物质A可以被直接氧化为D,其化学方程式可表示为 。
(4)写出下列反应的化学方程式
② ;
④ 。
查看答案和解析>>
科目:高中化学 来源:09-10年锦州一中高一下学期期中考试化学卷 题型:填空题
(本小题满分10分)已知A 是一种相对分子质量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。已知B、D是厨房常用调味剂。

请回答下列问题:
(1)写出A的结构简式 。
(2)B、D分子中的官能团名称分别是 、 。
(3)物质A可以被直接氧化为D,其化学方程式可表示为 。
(4)写出下列反应的化学方程式
② ;
④ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com