
【题目】下列化学方程式中,属于水解反应的是( )
A.CH3COOH+H2OCH3COO﹣+H3O+
B.HS﹣+H2OS2﹣+H3O+
C.CO2+H2OHCO3﹣+H+
D.CO32﹣+H2OHCO3﹣+OH﹣
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:___________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) ![]() CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g) ![]() CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g) ![]() CH3OCH3(g) + CO2 (g)的ΔH= ___________;
CH3OCH3(g) + CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。达到平衡时甲醇的转化率α(CH3OH)= _________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种既能提供电能又能固氮的新型氢氮燃料电池的工作原理如图所示,其中电解质溶液为溶有化合物A的稀盐酸。下列有关表述错误的是( )
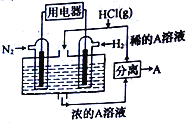
A. 通入N2的电极发生的电极反应式为N2+6e-+8H+=2NH4+
B. 该装置能将化学能转化为电能,化合物A为NH4Cl
C. 电子从通入N2的电极流出,经过用电器流向通入H2的电极
D. 反应过程中电解质溶液的pH会变大,故需要通入氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可利用下图中的实验装置测定足量铜与适量一定浓度的浓硝酸反应生成NO和NO2的物质的量之比(用m表示),其中装置C由广口瓶和量气管组成,量气管由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0mL~50mL),乙管可上下移动。
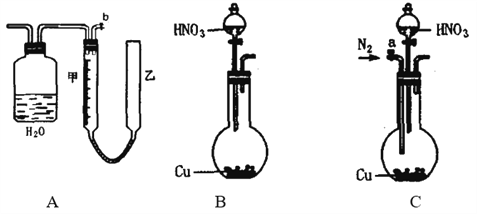
请回答下列问题:
(1)实验中气体(NO和NO2)发生装置应选择___________(填装置序号)。
(2)实验中气体(NO和NO2)通入C装置,请在下图的广口瓶中将导气管画出______。

(3)连接好装置,检查气密性后,应进行的操作:
第一:打开b,向C装置的乙管中加适量水;
第二:_________________________________________________________________________;
第三:将分液漏斗颈上的玻璃塞打开,再将分液漏斗下面的活塞拧开,向烧瓶中加入浓硝酸,与铜反应。
(4)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面。此时应将乙管_______(填“向上”或“向下”)移动,使________________________。
(5)实验后若量气管中气体的体积(已换算成标准状况)为V(L),C中硝酸的物质的量为n mol,则用含n和V的式子表示m=____________________________(结果可不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存于同一溶液中的是( )
A.Fe2+ H+ NO3﹣ SO42﹣
B.Fe3+ NH4+ Cl﹣ I﹣
C.Cu2+ Mg2+ NO3﹣ Cl﹣
D.Al3+ Na+ SO42﹣ OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ)、Mn(II)、Ni(II)等杂质)的流程如下:

提示:在本实验条件下,Ni(II)不能被氧化;高锰酸钾的还原产物是MnO2。回答下列问题:
(1)反应②中除掉的杂质离子是____________,写出其中发生的一个反应的离子方程式为___________________________________________________________________________;
在加高锰酸钾溶液前,若pH较低,对除杂的影响是______________________________________
(2)反应③的反应类型为_______________过滤得到的滤渣中,除了过量的锌外还有_____________
(3)反应④形成的沉淀要用水洗,检查沉淀洗涤干净的方法是_____________________________
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2。取干燥后的滤饼11.2g,煅烧后可得到产品8.1g,则x等于_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中生成H2的速率最快的是
金属 | 酸溶液 | 温度 | |
A | Mg | 0.5molL-1H2SO4 | 20℃ |
B | Fe | 1 molL-1HCl | 20℃ |
C | Zn | 2 molL-1HCl | 20℃ |
D | Mg | 1 molL-1H2SO4 | 30℃ |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com