
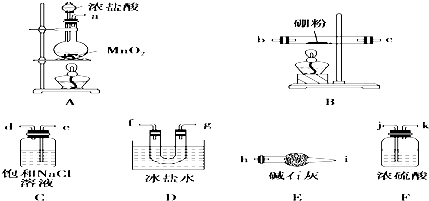
分析 (1)A中为浓盐酸和二氧化锰的反应,在加热条件下反应生成氯气;
(2)装置连接的顺序为气体发生装置---除杂装置--反应装置--收集装置--尾气处理装置的顺序,即:制备氯气(装置A)→净化氯气(装置C、F)→发生装置(B装置)→收集装置(装置D)→尾气处理装置(装置E).以此可确定连接顺序;
反应的原理为3Cl2+2B$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3,实验室制备氯气,应先后分别饱和食盐水、浓硫酸得到纯净的氯气,然后与B在加热条件下反应生成BCl3,
(3)装置E内装有碱石灰,可与氯气反应,防止污染空气,具有吸水作用,可防止空气中的水蒸气进入U形管;实验中若不用装置C,可发生2B+6HCl$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3+3H2↑,氢气和氯气易发生爆炸;
(4)BCl3发生水解反应生成硼酸和HCl.
解答 解:(1)根据装置A的药品和反应条件可知该装置是实验室制备氯气的装置,其中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)根据实验目的“某兴趣小组拟选用下列装置制备BCl3”,依据的原理是3Cl2+2B$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3,所以装置连接的顺序应该为气体发生装置---除杂装置--反应装置--收集装置--尾气处理装置的顺序,又实验室制备氯气中夹杂有氯化氢和水,且应先除去HCl再除去水,按气流方向连接各装置的接口,顺序为a→e→d→j→k→b→c→f→g→h,即:ACFBDE,
故答案为:ACFBDE;
(3)装置E是一个盛有碱石灰的干燥管,其作用一方面是吸收未反应的多余氯气,另一个方面也防止空气中的水蒸气进入U形管,实验中若不用装置C,则夹杂在氯气中的氯化氢也会进入盛有硼粉的玻璃管发生反应2B+6HCl$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3+3H2↑,可能产生的危险是氢气和氯气混合气体受热易爆炸,
故答案为:防止空气中的水进入U形管;吸收多余的氯气;氢气与氯气混合受热易爆炸;
(4)BCl3遇水产生大量的白雾,同时生成硼酸,是发生水解反应的原因,发生的方程式为BCl3+3H2O=3HCl+H3BO3,
故答案为:BCl3+3H2O=3HCl+H3BO3.
点评 本题考查物质的制备实验,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意把握实验的原理和注意事项,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子一定比原子大 | |
| B. | 所有原子的原子核都是由质子和中子构成 | |
| C. | 分子、原子、离子都是构成物质的粒子 | |
| D. | 物质状态发生变化,是因为粒子大小发生了变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L 氮气所含的原子数目为NA | |
| B. | 在反应3SiO2+6C+2N2=Si3N4+6CO,生成1 mol Si3N4时共转移12 NA电子 | |
| C. | 1molNa2O2固体中含离子总数为4 NA | |
| D. | 25℃时pH=13的NaOH溶液中含有Na+的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 | |
| B. | 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 | |
| C. | 氢氧燃料电池的能量转换形式之一为化学能转化为电能 | |
| D. | 催化剂通过降低化学反应的焓变加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03 mol/L | B. | 0.04 mol/L | C. | 0.05 mol/L | D. | 0.06mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| B. | 加入氢氧化钠溶液,先产生白色沉淀,后迅速变为灰绿色,最后变为红褐色,一定有Fe2+ | |
| C. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | 向氯化铁溶液中加入NaOH溶液,可制得Fe(OH)3胶体 | |
| C. | 固体的NaCl不导电,熔融态的NaCl可以导电 | |
| D. | 在河流入海口处易形成三角洲原理与胶体的性质无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钾和氧化汞都属于氧化物 | B. | 氧气和臭氧都属于单质 | ||
| C. | 碳酸钙和甲烷都属于有机物 | D. | 火碱和纯碱都属于碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com