
 Ņ»¶ØĢõ¼žĻĀĢśæÉŅŌŗĶCO2·¢Éś·“Ó¦£ŗFe£Øs£©+CO2£Øg£©?FeO£Øs£©+CO£Øg£©”÷H£¾0£¬1100”ꏱ£¬ĻņijĆܱÕČŻĘ÷ÖŠ¼ÓČė×ćĮæĢś·Ū²¢³äČėŅ»¶ØĮæµÄCO2ĘųĢ壬·“Ó¦¹ż³ĢÖŠCO2ĘųĢåŗĶCOĘųĢåµÄÅضČÓėŹ±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®
Ņ»¶ØĢõ¼žĻĀĢśæÉŅŌŗĶCO2·¢Éś·“Ó¦£ŗFe£Øs£©+CO2£Øg£©?FeO£Øs£©+CO£Øg£©”÷H£¾0£¬1100”ꏱ£¬ĻņijĆܱÕČŻĘ÷ÖŠ¼ÓČė×ćĮæĢś·Ū²¢³äČėŅ»¶ØĮæµÄCO2ĘųĢ壬·“Ó¦¹ż³ĢÖŠCO2ĘųĢåŗĶCOĘųĢåµÄÅضČÓėŹ±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®| ČŻĘ÷ | ¼× | ŅŅ |
| ·“Ó¦ĪļĶ¶ČėĮæ | 3mol Fe”¢ 2mol CO2 | 4mol FeO”¢ 3mol CO |
| COµÄÅØ¶Č£Ømol•L-1£© | c1 | c2 |
| CO2µÄĢå»ż·ÖŹż | ¦Õ1 | ¦Õ2 |
| ĢåĻµŃ¹Ēæ£ØPa£© | p1 | p2 |
| ĘųĢ¬·“Ó¦ĪļµÄ×Ŗ»ÆĀŹ | ¦Į1 | ¦Į2 |
·ÖĪö £Ø1£©»ÆŃ§Ę½ŗā³£ŹżKµČÓŚÉś³ÉĪļÅضČĆŻÖ®»żÓė·“Ó¦ĪļÅضČĆŻÖ®»żµÄ±Čµ«Éś³ÉĪļ»ņ·“Ó¦Īļ±ŲŠėŹĒĘųĢå»ņČÜŅŗ£»
£Ø2£©»ÆŃ§Ę½ŗā³£ŹżÖ»ÓėĪĀ¶ČÓŠ¹Ų£¬Óė·“Ó¦ĪļÅØ¶Č¼°Ń¹ĒæĪŽ¹Ų£»
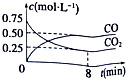
£Ø3£©8·ÖÖÓÄŚ£¬CO2µÄĘ½¾ł·“Ó¦ĖŁĀŹv£ØCO2£©=$\frac{”÷c}{”÷t}$£»
£Ø4£©¢ŁA£®ŗćĪĀŗćČŻĢõ¼žĻĀ£¬Ń¹ĒæÖ®±ČµČÓŚĘųĢåµÄĪļÖŹµÄĮæÖ®±Č£»
B£®ĪĀ¶Č²»±ä»ÆŃ§Ę½ŗā³£Źż²»±ä£¬»ÆŃ§Ę½ŗā³£ŹżK=$\frac{c£ØCO£©}{c£ØC{O}_{2}£©}$£»
C£®øĆĪĀ¶ČĻĀ»ÆŃ§Ę½ŗā³£ŹżK=$\frac{0.50}{0.25}$=2
¼× Fe£Øs£©+CO2£Øg£©?FeO£Øs£©+CO£Øg£©
·“Ó¦£Ømol/L£© c1 c1
Ę½ŗā£Ømol/L£© 1-c1 c1
»ÆŃ§Ę½ŗā³£ŹżK=$\frac{{c}_{1}}{1-{c}_{1}}$=2£¬
ŅŅ Fe£Øs£©+CO2£Øg£©?FeO£Øs£©+CO£Øg£©
·“Ó¦£Ømol/L£© 1.5-c2 1.5-c2
Ę½ŗā£Ømol/L£© 1.5-c2 c2
»ÆŃ§Ę½ŗā³£ŹżK=$\frac{{c}_{2}}{1.5-{c}_{2}}$£¬
ĪĀ¶Č²»±ä»ÆŃ§Ę½ŗā³£Źż²»±ä£¬¾Ż“Ė¼ĘĖćc1”¢c2¹ŲĻµ£»
D£®¼× Fe£Øs£©+CO2£Øg£©?FeO£Øs£©+CO£Øg£©
·“Ó¦£Ømol/L£© ¦Į1 ¦Į1
Ę½ŗā£Ømol/L£© 1-¦Į1 ¦Į1
»ÆŃ§Ę½ŗā³£ŹżK=$\frac{{¦Į}_{1}}{1-{¦Į}_{1}}$
ŅŅ Fe£Øs£©+CO2£Øg£©?FeO£Øs£©+CO£Øg£©
·“Ó¦£Ømol/L£© 1.5¦Į2 1.5¦Į2
Ę½ŗā£Ømol/L£© 1.5¦Į2 1.5£Ø1-¦Į2£©
»ÆŃ§Ę½ŗā³£ŹżK=$\frac{1.5£Ø1-{¦Į}_{2}£©}{1.5{¦Į}_{2}}$£¬
ĪĀ¶Č²»±ä»ÆŃ§Ę½ŗā³£Źż²»±ä£¬¾Ż“Ė¼ĘĖć¦Į1”¢¦Į2¹ŲĻµ£»
¢ŚøĆĪĀ¶ČĻĀ»ÆŃ§Ę½ŗā³£ŹżK=$\frac{0.50}{0.25}$=2£¬K=$\frac{{c}_{1}}{1-{c}_{1}}$=2£¬K=$\frac{1.5£Ø1-{¦Į}_{2}£©}{1.5{¦Į}_{2}}$£¬
¾Ż“Ė¼ĘĖćc1”¢a2£®
½ā“š ½ā£ŗ£Ø1£©»ÆŃ§Ę½ŗā³£ŹżKµČÓŚÉś³ÉĪļÅضČĆŻÖ®»żÓė·“Ó¦ĪļÅضČĆŻÖ®»żµÄ±Čµ«Éś³ÉĪļ»ņ·“Ó¦Īļ±ŲŠėŹĒĘųĢå»ņČÜŅŗ£¬ĖłŅŌøĆ·“Ó¦»ÆŃ§Ę½ŗā³£ŹżK=$\frac{c£ØCO£©}{c£ØC{O}_{2}£©}$£¬
¹Ź“š°øĪŖ£ŗ$\frac{c£ØCO£©}{c£ØC{O}_{2}£©}$£»
£Ø2£©»ÆŃ§Ę½ŗā³£ŹżÖ»ÓėĪĀ¶ČÓŠ¹Ų£¬Óė·“Ó¦ĪļÅØ¶Č¼°Ń¹ĒæĪŽ¹Ų£¬øĆ·“Ó¦µÄÕż·“Ó¦ŹĒĪüČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāÕżĻņŅĘ¶Æ£¬»ÆŃ§Ę½ŗā³£ŹżKŌö“󣬹ŹŃ”B£»
£Ø3£©8·ÖÖÓÄŚ£¬CO2µÄĘ½¾ł·“Ó¦ĖŁĀŹv£ØCO2£©=$\frac{”÷c}{”÷t}$=$\frac{£Ø0.75-0.25£©mol/L}{8min}$=0.0625mol/£ØL£®min£©£¬
¹Ź“š°øĪŖ£ŗ0.0625£»
£Ø4£©¢ŁA£®ŗćĪĀŗćČŻĢõ¼žĻĀ£¬Ń¹ĒæÖ®±ČµČÓŚĘųĢåµÄĪļÖŹµÄĮæÖ®±Č£¬·“Ó¦Ē°ŗóĘųĢåµÄ×ÜĪļÖŹµÄĮæ²»±ä£¬ĖłŅŌ¼×ÖŠĘųĢå×ÜĪļÖŹµÄĮæŹĒ2mol”¢ŅŅÖŠŹĒ3mol£¬Ōņ¼×ÖŠŃ¹ĒæŠ”ÓŚŅŅ£¬¼“p1£¼p2£¬¹ŹÕżČ·£»
B£®ĪĀ¶Č²»±ä»ÆŃ§Ę½ŗā³£Źż²»±ä£¬¼×”¢ŅŅÖŠĪĀ¶ČĻąĶ¬£¬ĖłŅŌ»ÆŃ§Ę½ŗā³£ŹżK=$\frac{c£ØCO£©}{c£ØC{O}_{2}£©}$ĻąµČ£¬ĖłŅŌ¦Õ1=¦Õ2£¬¹ŹÕżČ·£»
C£®¼× Fe£Øs£©+CO2£Øg£©?FeO£Øs£©+CO£Øg£©
·“Ó¦£Ømol/L£© c1 c1
Ę½ŗā£Ømol/L£© 1-c1 c1
»ÆŃ§Ę½ŗā³£ŹżK=$\frac{{c}_{1}}{1-{c}_{1}}$
ŅŅ Fe£Øs£©+CO2£Øg£©?FeO£Øs£©+CO£Øg£©
·“Ó¦£Ømol/L£© 1.5-c2 1.5-c2
Ę½ŗā£Ømol/L£© 1.5-c2 c2
»ÆŃ§Ę½ŗā³£ŹżK=$\frac{{c}_{2}}{1.5-{c}_{2}}$£¬
ĪĀ¶Č²»±ä»ÆŃ§Ę½ŗā³£Źż²»±ä£¬ĖłŅŌK=$\frac{{c}_{1}}{1-{c}_{1}}$=$\frac{{c}_{2}}{1.5-{c}_{2}}$£¬ĖłŅŌ3c1=2c2£¬¹Ź“ķĪó£»
D£®øĆĪĀ¶ČĻĀ»ÆŃ§Ę½ŗā³£ŹżK=$\frac{0.50}{0.25}$=2
¼× Fe£Øs£©+CO2£Øg£©?FeO£Øs£©+CO£Øg£©
·“Ó¦£Ømol/L£© ¦Į1 ¦Į1
Ę½ŗā£Ømol/L£© 1-¦Į1 ¦Į1
»ÆŃ§Ę½ŗā³£ŹżK=$\frac{{¦Į}_{1}}{1-{¦Į}_{1}}$
ŅŅ Fe£Øs£©+CO2£Øg£©?FeO£Øs£©+CO£Øg£©
·“Ó¦£Ømol/L£© 1.5¦Į2 1.5¦Į2
Ę½ŗā£Ømol/L£© 1.5¦Į2 1.5£Ø1-¦Į2£©
»ÆŃ§Ę½ŗā³£ŹżK=$\frac{1.5£Ø1-{¦Į}_{2}£©}{1.5{¦Į}_{2}}$£¬
ĪĀ¶Č²»±ä»ÆŃ§Ę½ŗā³£Źż²»±ä£¬ĖłŅŌK=$\frac{{¦Į}_{1}}{1-{¦Į}_{1}}$=$\frac{1.5£Ø1-{¦Į}_{2}£©}{1.5{¦Į}_{2}}$=2£¬
ĖłŅŌ¦Į1+¦Į2=1£¬a1”¢a2·Ö±šĪŖ$\frac{2}{3}$”¢$\frac{1}{3}$£¬¹Ź“ķĪó£»
¢ŚøĆĪĀ¶ČĻĀ»ÆŃ§Ę½ŗā³£ŹżK=$\frac{0.50}{0.25}$=2£¬K=$\frac{{c}_{1}}{1-{c}_{1}}$=2£¬K=$\frac{1.5£Ø1-{¦Į}_{2}£©}{1.5{¦Į}_{2}}$£¬
c1=0.67mol/L”¢a2=33.3%£¬
¹Ź“š°øĪŖ£ŗ0.67 mol•L-1£»33.3%£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗāÓ°ĻģŅņĖŲ”¢»ÆŃ§Ę½ŗāµÄ¼ĘĖć£¬²ąÖŲæ¼²éѧɜ·ÖĪö¼ĘĖćÄÜĮ¦£¬Ć÷Č·»ÆŃ§Ę½ŗā³£ŹżÖ»ÓėĪĀ¶ČÓŠ¹Ų”¢ĪĀ¶ČĻąĶ¬»ÆŃ§Ę½ŗā³£ŹżĻąµČŹĒ½ā±¾Ģā¹Ų¼ü£¬×¢Ņā»ÆŃ§Ę½ŗā¼ĘĖć·½·Ø£¬ĢāÄæÄѶČÖŠµČ£®


 æ¼Ē°±ŲĮ·ĻµĮŠ“š°ø
æ¼Ē°±ŲĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ag+”¢Cu2+”¢NO3-”¢Na+ | B£® | NO3-”¢Fe3+”¢Mg2+”¢SO42- | ||
| C£® | Na+”¢Ca2+”¢Cl-”¢CO32- | D£® | K+”¢Ba2+”¢Cl-”¢NO3- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚŅ»¶ØĢõ¼žĻĀ£¬Ä³æÉÄę·“Ó¦ÕżĻņŹĒĪüČČ·“Ó¦£¬ŌņĘäÄęĻņ±ŲŹĒ·ÅČČ·“Ó¦ | |
| B£® | 1 mol A£ØĒæĖį£©Óė1 mol B£ØĒæ¼ī£©·¢ÉśÖŠŗĶ·“Ó¦Ėł·Å³öµÄČČĮ潊×öÖŠŗĶČČ | |
| C£® | ¶ž“Īµē³Ų³äµēŹ±½«µēÄÜ×Ŗ»ÆĪŖ»ÆѧÄÜ | |
| D£® | ŠčŅŖ¼ÓČČ²ÅÄÜ·¢ÉśµÄ·“Ó¦æÉÄÜŹĒĪüČČ·“Ó¦Ņ²æÉÄÜŹĒ·ÅČČ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com