
| A. | 步骤(3)后可以确定CO32-一定不存在 | |
| B. | 忽略步骤(1)对实验结论并无影响 | |
| C. | 不能确定原溶液是否含有K+和Cl- | |
| D. | 若把步骤(2)产生的气体通入步骤(1)的滤液中,又可产生0.78g沉淀 |
分析 (1)第一份加入几滴AgNO3溶液后有沉淀产生,溶液中可能含有Cl-、CO32-、SO42-;
(2)第二份加过量NaOH溶液加热后,只收集到气体0.03mol,无沉淀生成,同时得到溶液甲,说明溶液中不存在Fe3+、Mg2+;
(3)在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g,说明原溶液中一定存在Al3+,结合离子共存可知一定不存在CO32-;1.02g为氧化铝的质量,其物质的量为:$\frac{1.02g}{102g/mol}$=0.01mol,说明每份溶液中含有0.02molAl3+;
(4)第三份加足量BaCl2溶液后,得白色沉淀,该白色沉淀为硫酸钡,说明原溶液中一定存在SO42-,沉淀经足量盐酸洗涤、干燥后,质量为11.65g,则硫酸钡的物质的量为:$\frac{11.65g}{233g/mol}$=0.05mol,说明每份溶液中含有0.05molSO42-;
0.02molAl3+所带正电荷为0.06mol,0.05molSO42-所带负电荷为0.1mol,根据电荷守恒可知,说明溶液中一定还含有阳离子K+,据此对各选项进行判断.
解答 解:第一份加入几滴AgNO3溶液后有沉淀产生,溶液中可能含有Cl-、CO32-、SO42-;第二份加过量NaOH溶液加热后,只收集到气体0.03mol,无沉淀生成,同时得到溶液甲,说明溶液中不存在Fe3+、Mg2+;在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g,说明原溶液中一定存在Al3+,结合离子共存可知一定不存在CO32-;1.02g为氧化铝的质量,其物质的量为:$\frac{1.02g}{102g/mol}$=0.01mol,说明每份溶液中含有0.02molAl3+;第三份加足量BaCl2溶液后,得白色沉淀,该白色沉淀为硫酸钡,说明原溶液中一定存在SO42-,沉淀经足量盐酸洗涤、干燥后,质量为11.65g,则硫酸钡的物质的量为:$\frac{11.65g}{233g/mol}$=0.05mol,说明每份溶液中含有0.05molSO42-;
0.02molAl3+所带正电荷为0.06mol,0.05molSO42-所带负电荷为0.1mol,根据电荷守恒可知,说明溶液中一定还含有阳离子K+,
A.根据分析可知,步骤(3)中可以确定溶液中一定含有铝离子,则可以确定CO32-一定不存在,故A正确;
B.步骤(1)中无法确定具体离子,且对后续步骤没有影响,可以忽略,故B正确;
C.根据分析可知,溶液中一定含有K+,故C错误;
D.每份溶液中含有0.02mol铝离子,向步骤(1)的溶液中通入0.03mol氨气,可以生成0.01mol氢氧化铝沉淀,质量为:78g/mol×0.01mol=0.78g,故D正确;
故选C.
点评 本题考查了离子的性质及检验方法,题目难度中等,注意掌握常见离子的性质及检验方法,利用溶液电中性判断钾离子的存在为解答关键,也是易错点,试题培养了学生的分析、理解能力、逻辑推理能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 丙烷的分子式是C3H6 | |
| B. | 丙烷分子中的碳原子在一条直线上 | |
| C. | 丙烷在光照条件下能够发生取代反应 | |
| D. | 丙烷的熔点比乙烷低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
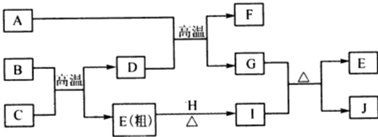
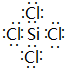 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
| 0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| ① | 30 | 20 | 30 | 20 | 18 | |
| ② | 30 | 20 | 30 | 20 | 温度65℃ | 13 |
| ③ | 30 | 20 | 30 | 20 | 少量MnSO4固体 | 3.6 |
| ④ | 30 | 20 | x | 20 | 5mL 10mol/L K2SO4溶液 | 18 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

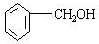 ;
; ;
;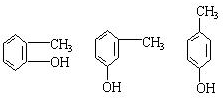
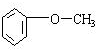 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙两位同学为验证Mg和Al的金属活动性强弱,分别设计了如图所示的实验装置:
甲、乙两位同学为验证Mg和Al的金属活动性强弱,分别设计了如图所示的实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 盐 | 熔点(℃) | 熔化吸热(kJ•mol-1) | 参考价格(元•t-1) |
| CaCl2•6H2O | 29.9 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 35.1 | 100.1 | 1 600~2 000 |
| Na2S2O3•5H2O | 45.0 | 49.7 | 1 400~1 800 |
| A. | CaCl2•6H2O | B. | Na2SO4•10H2O | C. | Na2HPO4•12H2O | D. | Na2S2O3•5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
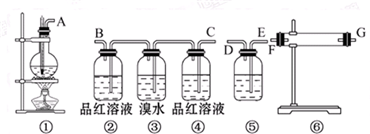
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com