
分析 (1)元素锡比同主族碳的周期数大3,二者原子序数相差第三、四、五周期容纳元素种数之和;
(2)Fe2(SO4)3将Sn2+全部氧化为Sn4+,再用溶液K2Cr2O7溶液滴定,将Fe2+氧化为Fe3+,根据电子转移守恒,整个过程关系式为:3Sn~3Sn2+~6Fe3+~6Fe2+~Cr2O72-,据此计算;
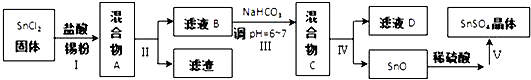
(3)由于Sn2+易水解、易被氧化,加入盐酸,抑制Sn2+水解,加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化,步骤Ⅱ为过滤,得SnCl2溶液,向其中加碳酸氢钠,调节溶液pH,使Mn元素以SnO形式沉淀,再过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体,滤液D中含有大量的NaCl等.
③得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,变质发生水解反应生成Sn(OH)2与二氧化碳,Sn(OH)2再脱水得到SnO;
④沉淀为SnO表面附着着Cl-,要想检验滤渣是否洗涤干净,用硝酸、硝酸银溶液检验最后一次洗涤液中是否含有Cl-;
⑤由流程图可知,操作V是从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶;
(4)SnCl4水解得到Sn(OH)4与HCl,HCl与氨气反应得到NH4Cl;
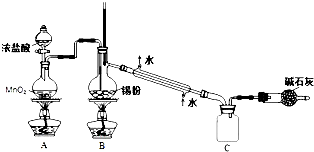
由于SnCl4易水解,制备中应在干燥环境中进行,制备的氯气中含有HCl、水蒸气,需要除去,防止Sn与HCl反应,SnCl4水解;
熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行.
解答 解:(1)元素锡比同主族碳的周期数大3,二者原子序数相差第三、四、五周期容纳元素种数之和,则Sn的原子序数为6+8+18+18=50,
故答案为:50;
(2)Fe2(SO4)3将Sn2+全部氧化为Sn4+,再用溶液K2Cr2O7溶液滴定,将Fe2+氧化为Fe3+,
设粉中锡的质量分数为x,则:
3Sn~3Sn2+~6Fe3+~6Fe2+~K2Cr2O7
3×119g 1mol
1.19g×x 0.100mol/L×0.02L
故3×119g:1.19g×x=1mol:0.100mol/L×0.02L
解得x=60%,
故答案为:将Sn2+全部氧化为Sn4+;60%.
(3)由于Sn2+易水解、易被氧化,加入盐酸,抑制Sn2+水解,加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化,步骤Ⅱ为过滤,得SnCl2溶液,向其中加碳酸氢钠,调节溶液pH,使Mn元素以SnO形式沉淀,再过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体,滤液D中含有大量的NaCl等.
①由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
故答案为:防止Sn2+被氧化;
②步骤Ⅱ是过滤,用到的玻璃仪器除烧杯外,还有漏斗、玻璃棒,
故答案为:漏斗、玻璃棒;
③得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,变质发生水解反应生成Sn(OH)2与二氧化碳,Sn(OH)2再脱水得到SnO,反应离子方程为:Sn2++2HCO3-=SnO↓+2CO2↑+H2O,
故答案为:Sn2++2HCO3-=SnO↓+2CO2↑+H2O;
④沉淀为SnO表面附着着Cl-,要想检验滤渣是否洗涤干净,用硝酸、硝酸银溶液检验最后一次洗涤液中是否含有Cl-,具体方案为:取最后一次滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀,说明洗涤干净
故答案为:取最后一次滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀;
⑤由流程图可知,操作V是从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶、过滤、洗涤得到,
故答案为:蒸发浓缩、冷却结晶;
(4)SnCl4水解得到Sn(OH)4与HCl,HCl与氨气反应得到NH4Cl,反应方程式为:SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;
由于SnCl4易水解,制备中应在干燥环境中进行,制备的氯气中含有HCl、水蒸气,需要除去,防止Sn与HCl反应,SnCl4水解,改进方法是:在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶;
熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行,
故答案为:SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶;熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行.
点评 本题属于拼合型题目,涉及物质制备方案、化学工艺流程、物质含量测定、元素周期表与元素周期律等,是对学生综合能力的考查,需要学生具备扎实的基础与良好的心理素质,难度中等.


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁表面涂油漆可增强其抗腐蚀性 | |
| B. | PM2.5是指大气中直径接近2.5×10-6m的颗粒,分散在空气中形成胶体 | |
| C. | 大量燃烧煤、石油等化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 含重金属离子的电镀废液不能随意排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
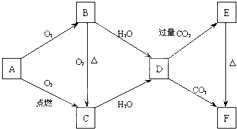 如图所示,A、B、C、D、E、F为金属钠或钠的化合物.
如图所示,A、B、C、D、E、F为金属钠或钠的化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下测得1mol N2的质量为28 g | |
| B. | 用100mL量筒测得排水法收集制得的氢气体积为50.28mL | |
| C. | 用两个250mL的容量瓶配制0.1 mol/L 500 mL的NaOH溶液 | |
| D. | 用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com