
| A. | C60与金刚石一样属于原子晶体 | |
| B. | 干冰升华破坏了共价键 | |
| C. | 共价化合物中一定不含离子键 | |
| D. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 |
科目:高中化学 来源: 题型:选择题
| A. | 丙烷与氯气在光照条件下生成氯丙烷 | |
| B. | 乙烯与溴的四氯化碳溶液反应生成1,2二溴乙烷 | |
| C. | 乙烯与水反应生成乙醇 | |
| D. | 乙烯自身聚合生成聚乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(N2)=0.1mol•L-1•s-1 | B. | v(H2)=0.1mol•L-1•min-1 | ||
| C. | v(NH3)=0.15mol•L-1•min-1 | D. | v(H2)=0.3mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元 素 | M | F | |
| 电能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该晶体中一定含有SCN- | |
| B. | Fe3+的氧化性比Br2的氧化性强 | |
| C. | Fe2+被Br2氧化为Fe3+ | |
| D. | Fe2+ 与SCN-不能形成血红色的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
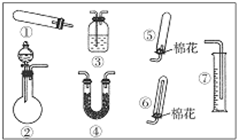 某同学用如图装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究.回答下列问题:
某同学用如图装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2分别通入BaCl2、Ba(NO3)2溶液中,都会观察到有白色沉淀生成 | |
| B. | 检验某酸性溶液中Cl-、SO42-,选用试剂及顺序是过量的AgNO3溶液、Ba(NO3)2溶液 | |
| C. | 纯锌与稀硫酸反应产生氢气的速率较慢,加入少量硫酸铜固体后,反应速率会加快 | |
| D. | 对于任意化学平衡,只要增大反应物浓度,都会使反应物转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 相关实验 | 预期目的 | |
| ① | 在两份同浓度同体积的H2O2溶液中,分别加2滴FeCl3溶液和2滴CuCl2溶液,前者放在热水中,后者放在冰水中.观察气泡快慢; | 验证温度对化学反应速率的影响. |
| ② | 将氯水加入淀粉KI溶液中 | 验证Cl的非金属性比I强 |
| ③ | 在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率. | 比较同周期金属元素的金属性强弱. |
| ④ | 利用电解质溶液的导电性装置,检测AlCl3溶液的导电性 | 证明AlCl3是离子化合物 |
| A. | 仅① | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com