
| A. | 熔点:正戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CCl4>H2O>苯 | |
| C. | 同质量的物质燃烧耗O2量:丙炔>乙烷>乙烯>乙炔>甲烷 | |
| D. | 同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |
分析 A.烷烃中,碳原子个数越多其熔沸点越高,同分异构体的烷烃,支链越多其熔沸点越低;
B.CCl4的密度大于1g/mL、水的密度是1g/mL、苯的密度小于1g/mL;
C.若烃为CxHy,同质量的物质燃烧耗O2量为$\frac{m}{M}$×(x+$\frac{y}{4}$);
D.若有机物为CxHyOz,同物质的量物质燃烧耗O2量为x+$\frac{y}{4}$-$\frac{z}{2}$.
解答 解:A.烷烃中,碳原子个数越多其熔沸点越高,同分异构体的烷烃,支链越多其熔沸点越低,所以熔点:2,2一二甲基戊烷>2,3一二甲基丁烷>戊烷>丙烷,故A错误;
B.CCl4的密度大于1g/mL、水的密度是1g/mL、苯的密度小于1g/mL,所以密度:CCl4>H2O>苯,故B正确;
C.若烃为CxHy,同质量的物质燃烧耗O2量为$\frac{m}{M}$×(x+$\frac{y}{4}$),显然甲烷消耗氧气最多,大小顺序为甲烷>乙烷>乙烯>丙炔>乙炔,故C错误;
D.若有机物为CxHyOz,同物质的量物质燃烧耗O2量为x+$\frac{y}{4}$-$\frac{z}{2}$,消耗氧气为已烷>环已烷>苯=苯甲酸,故D错误;
故选B.
点评 本题考查物质熔沸点高低判断、物质中元素含量判断、方程式的有关计算等知识点,侧重考查分析计算能力,注意CD中计算技巧,注意解题方法的积累及灵活运用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 非金属性:P>S>Cl | B. | 碱性:NaOH>KOH>RbOH | ||
| C. | 气态氢化物稳定性:HF>HCl>HBr | D. | 酸性:H2SO4>HClO4>HBrO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的电子式为 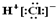 | B. | N2的结构式 N≡N | ||
| C. | O原子处于基态的轨道表示式: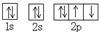 | D. | 用电子式表示MgCl2的形成: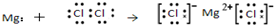 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1•min-1 | B. | 0.2 mol•L-1•min-1 | ||
| C. | 0.3 mol•L-1•min-1 | D. | 0.6 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
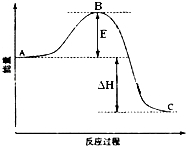 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com