
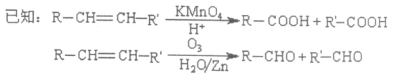
ŅŃÖŖÓŠ»śĪļFŗĶøß·Ö×ÓNµÄŗĻ³ÉĀ·ĻßČēĶ¼ĖłŹ¾£ŗ
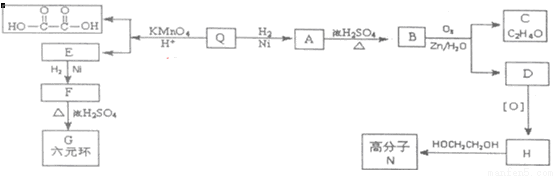
£Ø1£©2 mol FÉś³Él mol G”£QÖ»ŗ¬Ģ¼”¢Ēā”¢ŃõČżÖÖŌŖĖŲ£¬ĒŅĘäĢ¼”¢Ēā”¢ŃõŌŖĖŲÖŹĮæ±ČĪŖ9£ŗ1£ŗ6£¬¾²ā¶ØQµÄĻą¶Ō·Ö×ÓÖŹĮæŹĒ128”£1 mol QæÉÓėl mol Br2¼Ó³É£¬²¢ÄÜÓėl molNaHCO3Ē”ŗĆĶźČ«·“Ó¦£¬ĒŅ·Ö×ÓÖŠĪŽÖ§Į“”£QµÄ·Ö×ÓŹ½ŹĒ ”£
£Ø2£©AĖłŗ¬¹ŁÄÜĶŵÄĆū³ĘŹĒ ”¢ £»A”śBµÄ·“Ó¦ĄąŠĶŹĒ £»
£Ø3£©Š“³öCÓėŅų°±ČÜŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ £»
£Ø4£©GµÄ½į¹¹¼ņŹ½ŹĒ £»QµÄ·“Ź½½į¹¹¼ņŹ½ŹĒ ”£
£Ø5£©ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ ”£
a£®D“߻ƼÓĒāµÄ²śĪļÓėF»„ĪŖĶ¬·ÖŅģ¹¹Ģå
b£®FÄÜ·¢ÉśŃõ»Æ·“Ó¦”¢Č”“ś·“Ó¦”¢¼Ó³É·“Ó¦
c£®øß·Ö×ÓNµÄĆæĢõ·Ö×ÓĮ“ÖŠŗ¬ÓŠ(n-1)øöõ„»ł
£Ø6£©Š“³öĀś×ćĻĀĮŠĢõ¼žHµÄŅ»ÖÖĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½
¢ŁÄÜÓėNaHCO3·“Ó¦ ¢ŚÄÜ·¢ÉśŅų¾µ·“Ó¦ ¢ŪŗĖ“Ź²ÕńĒāĘ×ÓŠ4øöĪüŹÕ·ä
£Ø7£©Š“³öH NµÄ»Æѧ·½³ĢŹ½£ŗ ”£
NµÄ»Æѧ·½³ĢŹ½£ŗ ”£
 µ„ŌŖ¼ÓĘŚÄ©ø“Ļ°ĻČ·ę“óæ¼¾ķĻµĮŠ“š°ø
µ„ŌŖ¼ÓĘŚÄ©ø“Ļ°ĻČ·ę“óæ¼¾ķĻµĮŠ“š°ø ³ö²ŹĶ¬²½“óŹŌ¾ķĻµĮŠ“š°ø
³ö²ŹĶ¬²½“óŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016Ń§ÄźÉ½¶«Ź”×Ķ²©ŹŠø߶žÉĻµŚŅ»“Ī½×¶Ī²ā»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
¹ŲÓŚĪüČČ·“Ó¦µÄĖµ·Ø£¬ÕżČ·µÄŹĒ
A£®·²Šč¼ÓČȵķ“Ó¦Ņ»¶ØŹĒĪüČČ·“Ó¦ B£®Ö»ÓŠ·Ö½ā·“Ó¦²ÅŹĒĪüČČ·“Ó¦
C£®Ź¹ÓĆ“ß»Æ¼ĮµÄ·“Ó¦ŹĒĪüČČ·“Ó¦ D£®Ėį¼īÖŠŗĶ·“Ó¦µÄÄę·“Ó¦ŹĒĪüČČ·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģ¹ćĪ÷Ź”ĒÕÖŻŹŠĒÕÄĻĒųøßČżÉĻѧʌʌ֊֏Įæµ÷ŃŠ²āŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
Al”¢Fe”¢Cu¶¼ŹĒÖŲŅŖ¶ų³£¼ūµÄ½šŹō£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ
A£®ČżÕߵĵ„ÖŹŌŚ³£ĪĀĻĀ¶¼ÄÜČÜÓŚÅØĮņĖįŗĶÅØĻõĖį
B£®ČżÕߵĵ„ÖŹ·ÅÖĆŌŚæÕĘųÖŠ¾łÖ»Éś³ÉŃõ»ÆĪļ
C£®ČżÕßĖł¶ŌÓ¦µÄĒāŃõ»ÆĪļŌŚĖ®ÖŠ¶¼“ęŌŚČܽāĘ½ŗā
D£®¹¤ŅµÉĻÖʱøÕāČżÖÖ½šŹōµÄ·½·ØŅĄ“ĪĪŖµē½ā·Ø”¢ČČ·Ö½ā·ØŗĶČČ»¹Ō·Ø
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģŗÓÄĻŹ”ÄĻŃōŹŠøßČżÉĻѧʌʌ֊֏ĮæĘĄ¹Ą»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
Ģś·ŪŗĶĶ·ŪµÄ¾łŌČ»ģŗĻĪļ£¬Ę½¾ł·Ö³ÉĖĵȷŻ£¬·Ö±š¼ÓČėĶ¬ÅØ¶ČµÄĻ”ĻõĖį£¬³ä·Ö·“Ó¦£¬ŌŚ±ź×¼×“æöĻĀÉś³ÉNOµÄĢå»żŗĶŹ£Óą½šŹōµÄÖŹĮæČēĻĀ±ķ£ØÉčĻõĖįµÄ»¹Ō²śĪļÖ»ŗĶNO£©£ŗĻĀĮŠ¼ĘĖć½į¹ū“ķĪóµÄŹĒ
±ąŗÅ | ¢Ł | ¢Ś | ¢Ū | ¢Ü |
Ļ”ĻõĖįĢå»ż/mL | 100 | 200 | 300 | 400 |
Ź£Óą½šŹō/g | 18.0 | 9.6 | 0 | 0 |
NOĢå»ż/mL | 2240 | 4480 | 6720 | V |
A£®¢ŁÖŠČܽāĮĖ8.4gFe
B£®Ō»ģŗĻĪļ×ÜÖŹĮæĪŖ105.6g
C£®ĻõĖįµÄÅضČĪŖ4mol/L
D£®¢ÜÖŠV=6720
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģŗÓÄĻŹ”ÄĻŃōŹŠøßČżÉĻѧʌʌ֊֏ĮæĘĄ¹Ą»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠ·ÖĄą»ņ¹éĄąÕżČ·µÄŹĒ£ŗ¢ŁĀĮČČ¼Į”¢“æ¾»æóČŖĖ®”¢±łĖ®»ģŗĻĪļ¾łĪŖ»ģŗĻĪļ¢ŚNaOH”¢HD”¢lBr¾łĪŖ»ÆŗĻĪļ¢ŪĆ÷·Æ”¢ÉÕ¼ī”¢ĮņĖį¾łĪŖĒæµē½āÖŹ¢ÜC60”¢½šøÕŹÆ”¢ŹÆÄ«¾łĪŖĢ¼µÄĶ¬ĖŲŅģŠĪĢå¢Żµā¾Ę”¢µķ·ŪČÜŅŗ”¢Ė®Īķ”¢ÄÉĆײÄĮĻ¾łĪŖ½ŗĢå
A£®¢Ł¢Ū¢Ū¢Ż B£®¢Ū¢Ü¢Ż C£®¢Ś¢Ü¢Ż D£®¢Ū¢Ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģŗž±±Ź”ĖÉ×ĢŹŠøßČżÉĻѧʌʌ֊²āŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
X”¢Y¾łĪŖŌŖĖŲÖÜĘŚ±ķ¢÷A×åÖŠµÄĮ½ÖÖŌŖĖŲ”£ĻĀĮŠŠšŹöÖŠ£¬Äܹ»ĖµĆ÷XµÄŌ×ӵƵē×ÓÄÜĮ¦±ČYĒæµÄŹĒ
A£®Ō×ӵĵē×Ó²ćŹż£ŗX>Y
B£®¶ŌÓ¦µÄ¼ņµ„Ąė×ӵĻ¹ŌŠŌ£ŗX>Y
C£®ĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌ£ŗX>Y
D£®Ńõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄĖįŠŌ£ŗX>Y
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģŗž±±Ź”ĖÉ×ĢŹŠøßČżÉĻѧʌʌ֊²āŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠ·“Ó¦ÖŠ£¬Na2O2Ö»±ķĻÖĒæŃõ»ÆŠŌµÄŹĒ
A£®2Na2O2 + 2CO2 2Na2CO3 + O2
B£®Na2O2 + MnO2 =Na2MnO4
C£®5Na2O2 + 2MnO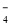 + 16H+ = 10Na+ + 2Mn2+ + 5O2”ü + 8H2O
+ 16H+ = 10Na+ + 2Mn2+ + 5O2ӟ + 8H2O
D£®2Na2O2 + 2H2SO4 = 2Na2SO4 +2H2O + O2”ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģ½ĖÕŹ”ÄĻĶØŹŠøßČżÉĻѧʌµŚŅ»“Ī½×¶Ī²ā»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ
A£®ŗĻ³É°±·“Ó¦ŠčŹ¹ÓĆ“ß»Æ¼Į£¬ĖµĆ÷“߻ƼĮæÉŅŌ“Ł½ųøĆĘ½ŗāĻņÉś³É°±µÄ·½ĻņŅʶÆ
B£®Ē¦Šīµē³ŲŌŚ·Åµē¹ż³ĢÖŠ£¬øŗ¼«ÖŹĮæŌö¼Ó£¬Õż¼«ÖŹĮæ¼õÉŁ
C£®100 mL pH£½3µÄHAŗĶHB·Ö±šÓė×ćĮæµÄŠæ·“Ó¦£¬HA·Å³öµÄĒāĘų¶ą£¬ĖµĆ÷HAĖįŠŌ±ČHBČõ
D£®ŅŃÖŖ
 I2£«I££¬ĻņŹ¢ÓŠKI3ČÜŅŗµÄŹŌ¹ÜÖŠ¼ÓČėŹŹĮæCCl4£¬Õńµ“¾²ÖĆŗóCCl4²ćĻŌ×ĻÉ«£¬ĖµĆ÷KI3ŌŚCCl4ÖŠµÄČܽā¶Č±ČŌŚĖ®ÖŠµÄ“ó
I2£«I££¬ĻņŹ¢ÓŠKI3ČÜŅŗµÄŹŌ¹ÜÖŠ¼ÓČėŹŹĮæCCl4£¬Õńµ“¾²ÖĆŗóCCl4²ćĻŌ×ĻÉ«£¬ĖµĆ÷KI3ŌŚCCl4ÖŠµÄČܽā¶Č±ČŌŚĖ®ÖŠµÄ“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğŌĘÄĻŹ”øßŅ»ÉĻѧʌ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ÓĆNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
A£®ŗ¬ÓŠNAøöŗ¤Ō×ÓµÄŗ¤ĘųŌŚ±ź×¼×“æöĻĀµÄĢå»żŌ¼ĪŖ11.2 L
B£®25”ę£¬1.01”Į105Pa,64 g SO2ÖŠŗ¬ÓŠµÄŌ×ÓŹżĪŖ3NA
C£®ŌŚ³£ĪĀ³£Ń¹ĻĀ£¬11.2 L Cl2ŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ0.5NA
D£®±ź×¼×“æöĻĀ£¬11.2 L H2Oŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ0.5NA
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com