
铝是最常见的金属之一。
(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是 。
(2)纳米铝主要应用于火箭推进剂。工业上利用无水氯化铝与氢化铝锂(LiAlH4)在有机溶剂中反应制得纳米铝,化学方程式如下:3LiAlH4+AlCl3="4Al" + 3LiCl + 6H2↑
该反应的氧化剂为 。
(3)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)= Na3AlH6 (s)+
Na3AlH6 (s)+  Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Na3AlH6(s)="3NaH(s)+" Al (s) + 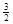 H2(g) ΔH=+ 70.5 kJ·molˉ1
H2(g) ΔH=+ 70.5 kJ·molˉ1
则NaAlH4(s)=" NaH(s)" + Al (s) +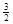 H2(g) ΔH= 。
H2(g) ΔH= 。
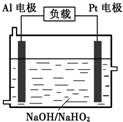
(4)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:
2Al+3HO2-+3H2O =2[Al(OH) 4]-+OH-
①正极反应式为 。
②与普通锌锰干电池相比,当消耗相同质量的负极活性物质时,Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的______倍。
③Al电极易被NaOH溶液化学腐蚀,这是该电池目前未能推广使用的原因之一。反应的离子方程式为 。
(9分)(1)常温下,铝易被浓硝酸、浓硫酸钝化
(2)LiAlH4、AlCl3 (3)+ 60.5 kJ·molˉ1
(4)① 3HO2-+3H2O+6e-=9OH-(或HO2-+H2O+2e-=3OH-)
② 3.6 (2分) ③ 2Al+6H2O+2OH-=2[Al(OH) 4]-+3H2↑
解析试题分析:(1)常温下,铝易被浓硝酸、浓硫酸钝化,所以浓硝酸、浓硫酸可贮存在铝制容器中。
(2)根据反应的方程式可知,铝元素的化合价从+3价降低到0价,得到电子,发生还原反应,所以氧化剂是LiAlH4、AlCl3 。
(3)根据盖斯定律可知,①+②×1/3,即得到反应式NaAlH4(s)=" NaH(s)" + Al (s) +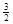 H2(g),所以该反应的△H=+37 kJ/mol+70.5 kJ/mol÷3=60.5 kJ/mol.
H2(g),所以该反应的△H=+37 kJ/mol+70.5 kJ/mol÷3=60.5 kJ/mol.
(4)①原电池中正极得到电子,则根据总的反应式可知Al失去电子,做负极,所以正极反应式是3HO2-+3H2O+6e-=9OH-(或HO2-+H2O+2e-=3OH-)。
②普通锌锰干电池中负极是锌,65g锌失去2mol电子,而65g铝失去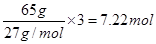 电子,所以Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的7.22÷2=3.6倍。
电子,所以Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的7.22÷2=3.6倍。
③铝能和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式是2Al+6H2O+2OH-=2[Al(OH) 4]-+3H2↑。
考点:考查铝的性质、用途、反应热的计算、电极反应式的书写以及有关计算
点评:该题是中等难度的试题,试题设计新颖,基础性强,有利于调动学生的学习兴趣和学习积极性,激发学生的学习求知欲,也有利于培养学生的规范答题能力和逻辑推理能力,提高学生的学习效率。


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高一下学期期末考试化学试卷(解析版) 题型:填空题
铝是最常见的金属之一。
(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是 。
(2)纳米铝主要应用于火箭推进剂。工业上利用无水氯化铝与氢化铝锂(LiAlH4)在有机溶剂中反应制得纳米铝,化学方程式如下:3LiAlH4+AlCl3="4Al" + 3LiCl + 6H2↑
该反应的氧化剂为 。
(3)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)=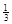 Na3AlH6 (s)+
Na3AlH6 (s)+  Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Na3AlH6(s)="3NaH(s)+"
Al (s) +  H2(g) ΔH=+ 70.5 kJ·molˉ1
H2(g) ΔH=+ 70.5 kJ·molˉ1
则NaAlH4(s)="
NaH(s)" + Al (s) + H2(g) ΔH= 。
H2(g) ΔH= 。

(4)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式 存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:
2Al+3HO2-+3H2O =2[Al(OH) 4]-+OH-
①正极反应式为 。
②与普通锌锰干电池相比,当消耗相同质量的负极活性物质时,Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的______倍。
③Al电极易被NaOH溶液化学腐蚀,这是该电池目前未能推广使用的原因之一。反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014届福建省高二下学期期中考化学卷(解析版) 题型:填空题
铝是最常见的金属之一。
(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是 。
(2)纳米铝主要应用于火箭推进剂。工业上利用无水氯化铝与氢化铝锂(LiAlH4)在有机溶剂中反应制得纳米铝,化学方程式如下:3LiAlH4+AlCl3="4Al" + 3LiCl + 6H2↑
该反应的氧化剂为 。
(3)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)=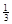 Na3AlH6 (s)+
Na3AlH6 (s)+  Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Na3AlH6(s)="3NaH(s)+"
Al (s) +  H2(g) ΔH=+ 70.5 kJ·molˉ1
H2(g) ΔH=+ 70.5 kJ·molˉ1
则NaAlH4(s)="
NaH(s)" + Al (s) + H2(g) ΔH= 。
H2(g) ΔH= 。

(4)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:
2Al+3HO2-+3H2O =2[Al(OH) 4]-+OH-
①正极反应式为 。
②与普通锌锰干电池相比,当消耗相同质量的负极活性物质时,Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的______倍。
③Al电极易被NaOH溶液化学腐蚀,这是该电池目前未能推广使用的原因之一。反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是最常见的金属之一。
(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是 。
(2)纳米铝主要应用于火箭推进剂。工业上利用无水氯化铝与氢化铝锂(LiAlH4)在有机溶剂中反应制得纳米铝,化学方程式如下:3LiAlH4+AlCl3=4Al + 3LiCl + 6H2↑
该反应的氧化剂为 。
(3)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)=![]() Na3AlH6 (s)+
Na3AlH6 (s)+ ![]() Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Na3AlH6(s)=3NaH(s)+ Al (s) + ![]() H2(g) ΔH=+ 70.5 kJ·molˉ1
H2(g) ΔH=+ 70.5 kJ·molˉ1
则NaAlH4(s)= NaH(s) + Al (s) +![]() H2(g) ΔH= 。
H2(g) ΔH= 。


(4)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式 存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:
2Al+3HO2-+3H2O =2[Al(OH) 4]-+OH-
①正极反应式为 。
②与普通锌锰干电池相比,当消耗相同质量的负极活性物质时,Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的______倍。
③Al电极易被NaOH溶液化学腐蚀,这是该电池目前未能推广使用的原因之一。反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com