
| A. | 1mol氖气中含有的原子数目为NA | |
| B. | 5.85g NaCl中含有的最外层电子数目为1.6NA | |
| C. | 2mol NO和1mol O2混合,充分反应后转移的电子数目为4NA | |
| D. | 25℃时,1L 0.1mol•L-1 Na2S溶液中的阴离子数目小于0.1NA |
分析 A.氖气为单原子分子;
B.1mol钠离子最外层8mol电子,1mol氯离子最外层8mol电子;
C.2mol NO和1mol O2混合反应生成2mol二氧化氮,转移4mol电子;
D.硫离子水解生成硫氢根离子和氢氧根离子.
解答 解:A.1mol氖气中含有的原子数目为NA,故A正确;
B.5.85g NaCl物质的量为:$\frac{5.85g}{58.5g/mol}$=0.1mol,含有的最外层电子数目为16NA,故B正确;
C.2mol NO和1mol O2混合反应生成2mol二氧化氮,转移4mol电子,转移的电子数目为4NA,故C正确;
D.25℃时,1L 0.1mol•L-1 Na2S溶液中的阴离子数目大于0.1NA,故D错误;
故选:D.
点评 本题考查了阿伏伽德罗常数应用及有关计算,掌握以物质的量量为核心的计算公式的使用和物质的结构是解题关键,难度不大.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓HNO3能与碳反应,说明其具有强氧化性 | |
| B. | 浓HNO3能溶解金属铜,说明其具有强酸性 | |
| C. | 浓HNO3不稳定易分解,需要避光保存 | |
| D. | 常温下浓HNO3能使金属铝钝化,可以用铝槽车运输浓HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ②⑤⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
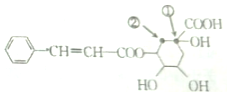
| A. | X分子中含有三种含氧官能团 | |
| B. | 若X中加入溴的四氯化碳溶液或酸性高锰酸钾溶液均褪色,则证明X分子中一定含有碳碳双键 | |
| C. | X能发生加成反应、取代反应、氧化反应和加聚反应 | |
| D. | 将①处碳原子上的-OH转移到②处碳原子上得到的有机物与X互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的一种单质的沸点比X的高 | |
| B. | 氧化物的水化物的酸性:Z>W | |
| C. | W与Y可形成一种硬度很大的化合物 | |
| D. | W、X、Y三种元素均可以与Z元素形成共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤所需实验用品有漏斗、烧杯、玻璃棒、铁架台(带铁圈) | |
| B. | 过滤时把漏斗放在铁三脚架上 | |
| C. | 过滤时将玻璃棒斜靠在三层滤纸上 | |
| D. | 过滤时为了加快过滤速度,用玻璃棒搅拌过滤器中的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e |
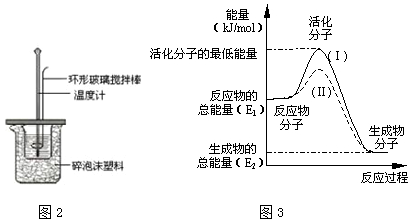
| 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃[ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com