
| 化学键 | C-C | C-H | H-H | C-O | C≡O | O-H |
| 键能/kJ/mol | 348 | 413 | 436 | 358 | x | 463 |
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol/L | 0.5 | 2 | 2 | 0.5 |
分析 (1)①已知:①CH3OH(g)=HCHO(g)+H2(g)△H=+84kJ/mol;②2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol,可利用盖斯定律将2×①+②得到CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式,
②增大反应物浓度,则使平衡正向移动;
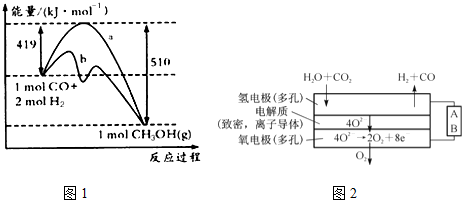
(2)①曲线a到曲线b,活化能降低,可加入催化剂;
②依据化学反应焓变=反应物键能总和-生成物键能总和来分析;
(3)①甲醇燃料电池中正极上氧气得电子生成二氧化碳,甲醇在负极失电子,碱溶液中生成碳酸盐;
②电解原理:阴极上显示铜离子得电子,然后是氢离子得电子产生氢气,在阳极上是氯离子失电子的反应,产生氯气,然后是氢氧根离子失电子产生氧气,一段时间后,当两极收集到相同体积(相同条件)的气体时,根据电子守恒计算阳极上收集到氧气的质量;
(4)由图示可知A极水、二氧化碳生成氢气、CO,应发生还原反应,为阴极反应.
解答 解:(1)①已知:①CH3OH(g)=HCHO(g)+H2(g)△H=+84kJ/mol;②2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol,将2×①+②得到CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式为2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)△H=-316 kJ•mol-1,
故答案为:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)△H=-316 kJ•mol-1;
②增大反应物浓度,则使平衡正向移动,提高甲醇的转化率,故答案为:提高甲醇的转化率;
(2)①曲线a到曲线b,活化能降低,应为加入催化剂,故答案为:加入催化剂;
②CO(g)+2H2(g)?CH3OH (g)的焓变=反应物总键能之和-生成物总键能之和,设CO中碳氧键的键能为X,结合图表提供的化学键的键能,则△H═X+2×436KJ/mol-(3×413KJ/mol+358KJ/mol+463KJ/mol)=(419-510)kJ•mol-1=-91kJ•mol-1,解得:X=1097KJ/mol,
故答案为:1097;
(3)①①燃料电池,电池的一个电极通 入空气,另一个电极通入甲醇气体,电解质是氢氧化钠溶液,根据原电池原理,正极电极反应是O2得到电子生成氢氧根离子-:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O-4e-=4OH-;
②阴极上显示铜离子得电子,Cu2++2e-=Cu,200mL0.5mol/L的铜离子得电子物质的量是0.2mol,然后是2H++2e-=H2↑,在阳极上是0.4mol氯离子失电子的反应,产生氯气0.2mol,2Cl--2e-=Cl2↑,转移电子是0.4mol,然后是氢氧根离子失电子产生氧气,4OH--4e-=O2↑+2H2O,当两极收集到相同体积(相同条件)的气体时,假设产生氧气的物质的量是x,在阳极上产生气体是(0.2+x)mol,根据电子守恒,得到0.4+4x=0.2+2(0.2+x),解得x=0.1mol,即阳极上收集到氧气的质量为3.2 g,
故答案为:3.2 g;
(4)由图示可知A极水、二氧化碳生成氢气、CO,应发生还原反应,为阴极反应,则A为电源的负极,生成氢气的反应为H2O+2e-=H2↑+O2-,
故答案为:负极;H2O+2e-=H2↑+O2-.
点评 本题考查较为综合,涉及反应热与焓变、化学平衡的移动以及电解等知识,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意把握反应热的计算以及电解的工作原理,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1 mol/LHX溶液中pH=1 | |
| B. | Ksp(CaX2)随温度和浓度的变化而变化 | |
| C. | 该体系中,c(Cl-)=c(Ca2+) | |
| D. | 该体系中HX与CaCl2反应产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、CO32-、NO3- | B. | Mg2+、NH4+、SO42-、Cl- | ||
| C. | Fe3+、K+、NO3-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol葡萄糖可水解生成2mol乳酸(C3H6O3) | |
| B. | 顺-2-丁烯和反-2-丁烯的加氢产物不同 | |
| C. | 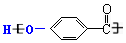 nOH的结构中含有酯基 nOH的结构中含有酯基 | |
| D. | 油脂和蛋白质都是能发生水解反应的高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com