
【题目】工业上烟气脱氮的原理![]()
(1)该反应化学平衡常数K的表达式为____________。温度升高,K值___________(选填“增大”、“减小”、“不变”)。如果平衡常数K值增大,对_______(填“正反应”或“逆反应”)的速率影响更大。
(2)若反应在恒容条件下进行,能说明反应已经达到平衡状态的是______(填序号)
a.容器内混合物的质量不变 b.容器内气体的压强不变
c.反应消耗0.5mol NO的同时生成1mol N2 d.![]() 的浓度不变
的浓度不变
(3)向2 L密闭容器中加入反应物,10 min后达到平衡,测得平衡时气体的物质的量增加了0.2mol,则用![]() 表示的平均反应速率为__________。
表示的平均反应速率为__________。
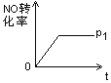
(4)如图是P1压强下NO的转化率随反应时间(t)的变化图,请在图中画出其他条件不变情况下,压强为![]() 下NO的转化率随反应时间变化的示意图。
下NO的转化率随反应时间变化的示意图。
 ______
______
(5)工业合成氨的反应温度选择500℃左右的原因是_______________。
(6)写出反应物中的氨气的电子式______;其空间构型为______;它常用来生产化肥![]() 。
。![]() 溶液显__________性;常温下将等体积等浓度的氨水和
溶液显__________性;常温下将等体积等浓度的氨水和![]() 溶液混合,pH>7,溶液中
溶液混合,pH>7,溶液中![]() 浓度由大到小的关系是_______________。
浓度由大到小的关系是_______________。
【答案】![]() 减小 逆反应 bd 0.03mol/(L·min)
减小 逆反应 bd 0.03mol/(L·min) 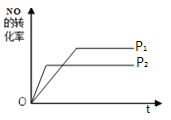 催化剂在500℃左右具有最佳活性
催化剂在500℃左右具有最佳活性 ![]() 三角锥形 酸性
三角锥形 酸性 ![]()
【解析】
(1)化学平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,该反应为放热反应,升高温度,对逆反应速率影响更大,平衡向逆反应方向移动;
(2)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,可以及由此衍生的一些量也不发生变化,由此进行判断;
(3)由平衡时气体的物质的量增加了0.2mol可知反应生成水的物质的量为0.6mol;
(4)该反应是一个气体体积增大的反应,增大压强,反应速率加快,达到平衡的时间减小,平衡向逆反应方向移动;
(5)工业合成氨的反应为放热反应,升高温度,平衡向逆反应方向移动,不利于增大氨气的产率,但500℃左右的温度是催化剂的活性温度,且反应速率较快;
(6)氨气为三角锥形的极性分子;氯化铵为强酸弱碱盐,铵根离子在溶液中水解使溶液呈酸性;常温下将等体积等浓度的氨水和氯化铵溶液混合溶液pH>7,说明氨水的电离大于铵根离子的水解。
(1)化学平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,则该反应化学平衡常数K的表达式为![]() ;该反应为放热反应,升高温度,对逆反应速率影响更大,平衡向逆反应方向移动,化学平衡常数减小,故答案为:
;该反应为放热反应,升高温度,对逆反应速率影响更大,平衡向逆反应方向移动,化学平衡常数减小,故答案为:![]() ;减小;逆反应;
;减小;逆反应;
(2)a、根据质量守恒,无论反应是否达平衡状态,混合物质量不变,容器的体积不变,所以混合气体的密度始终不变,容器内混合物的质量不变不能作为化学平衡状态的判断依据,故错误;
b、该反应是反应前后气体体积增大的反应,当压强不变时,各物质的浓度不再发生变化,容器内气体的压强不变能说明反应已经达到平衡状态,故正确;
c、反应消耗0.5mol NO和生成1mol N2均代表正反应速率,不能表示正逆反应速率相等,反应消耗0.5mol NO的同时生成1mol N2不能作为化学平衡状态的判断依据,故错误;
d、各物质的浓度不变说明反应达平衡状态,故正确;
bd正确,故答案为:bd;
(3)由化学方程式可知,反应生成3mol水,气体增加的物质的量为1mol,由平衡时气体的物质的量增加了0.2mol可知反应生成水的物质的量为3:1=n(H2O):0.2mol,解得n(H2O)=0.6mol,则10min后达到平衡,用水表示的平均反应速率为![]() =0.03mol/(L·min),故答案为:0.03mol/(L·min);
=0.03mol/(L·min),故答案为:0.03mol/(L·min);
(4)该反应是一个气体体积增大的反应,增大压强,反应速率加快,达到平衡的时间减小,平衡向逆反应方向移动,NO的转化率减小,则压强为P2时NO的转化率随反应时间变化的示意图为 ,故答案为:
,故答案为: ;
;
(5)工业合成氨的反应为放热反应,升高温度,平衡向逆反应方向移动,不利于增大氨气的产率,但500℃左右的温度是催化剂的活性温度,且反应速率较快,故答案为:催化剂在500℃左右具有最佳活性;
(6)氨气为三角锥形的极性分子,电子式为![]() ;氯化铵为强酸弱碱盐,铵根离子在溶液中水解使溶液呈酸性;常温下将等体积等浓度的氨水和氯化铵溶液混合溶液pH>7说明氨水的电离大于铵根离子的水解,则溶液中
;氯化铵为强酸弱碱盐,铵根离子在溶液中水解使溶液呈酸性;常温下将等体积等浓度的氨水和氯化铵溶液混合溶液pH>7说明氨水的电离大于铵根离子的水解,则溶液中![]() 各微粒浓度由大到小的关系是
各微粒浓度由大到小的关系是![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据:
实验编号 | 实验温度 | 试管中所加试剂及其用量 / mL | 溶液褪至无色所需时间/ min | |||
0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式_________,当该反应以表中数据反应完全时转移电子数为_______NA;
(2)V1=________ mL;
(3)根据上表中的实验①、②数据,可以得到的结论是________。
(4)探究温度对化学反应速率的影响,应选择________(填实验编号);
(5)该小组同学根据经验绘制了n(Mn 2+)随时间变化的趋势如图所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn 2+)随时间变化的实际趋势如图所示。
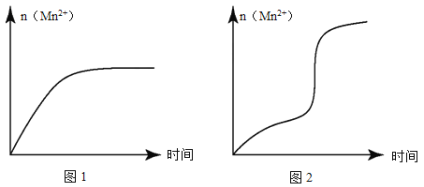
该小组同学根据如图所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再加入某种固体 | 溶液褪至无色所需时间 / min | |||
④ | 25 | 0.6mol/L H2C2O4 | H2O | 3mol/L H2SO4 | 0.05mol/L KMnO4溶液 | ||
2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t | ||
①小组同学提出的假设是_________。
②若该小组同学提出的假设成立,应观察到_______________________现象。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是H2(g)与I2(g)反应生成HI(g)的能量示意图。由图可知

A.该反应是吸热反应
B.1 mol HI(g)分解吸收的热量为Q
C.热化学方程式:H2+I2![]() 2HI+Q
2HI+Q
D.反应物总能量高于生成物总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A.新制氯水长时间放置颜色变浅
B.高压比常压更有利于 SO2 转化为 SO3
C.蒸干 AlCl3 溶液无法得到无水 AlCl3
D.滴加少量 CuSO4 溶液可以加快 Zn 与稀 H2SO4 反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃20mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了40mL,原混合烃中乙炔的体积分数为 ( )
A. 12.5%B. 25%C. 50%D. 75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水可以提取氯化钠、溴、碘等产品。海带提碘的流程如下:
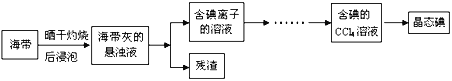
(1)CCl4含有___________键的______________分子(均选填“极性”或“非极性”)。
(2)灼烧海带时除需要三脚架、酒精灯、泥三角外,还需要的主要仪器是____________。
(3)为更好的完成实验,灼烧海带时,需加入一定量的氢氧化钠充分混合后再灼烧。此操作目的是___________________________________。
(4)向盛有碘离子溶液中加入CCl4和氯水,______(填:“上”或“下”)层呈紫红色;如果氯水加过量,CCl4层会由紫红色变成无色。整个过程中被氧化的微粒是__________________。写出并配平CCl4层由紫红色变成无色的化学反应方程式:__________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门实用性很强的科学。根据题意填空:
(1)古代锻造刀剑时,将炽热的刀剑快速投入水中“淬火”,反应为:3Fe+4H2O(g) ![]() Fe3O4+4H2。该反应中H2O作__________(填“氧化剂”或“还原剂”);
Fe3O4+4H2。该反应中H2O作__________(填“氧化剂”或“还原剂”);
(2)某同学炒菜时发现,汤汁溅到液化气的火焰上时,火焰呈黄色。据此他判断汤汁中含有________(填“钠”或“钾”)元素;
(3)海水提镁的重要步骤之一是用沉淀剂将海水中的Mg2+沉淀。该沉淀剂是__________(填“生石灰”或“盐酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。(已知:2KMnO4+16HCl(浓)→2KCl+2MnCl2+5Cl2↑+8H2O)

(1)b处的实验现象为___,d处的实验现象为_____。
(2)C处发生的离子方程式为____,其过程中包括___个平衡,通氯气对自来水进行杀菌消毒时,起主要作用的微粒是____。此微粒对水的电离平衡起到___“填促进”或“抑制”)作用。
(3)通过上述实验现象不能比较FeCl3与Br2氧化性的强弱,请设计实验比较两微粒氧化性的大小,并按要求回答下列问题:取___于试管中,滴加____,若溶液有____现象,说明___>___。
(4)二氧化氯(ClO2)在水处理领域有着广泛应用。与氯气相比,它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。反应时,ClO2生成ClO2-、Cl-的转化率与溶液的pH的关系如图所示。则pH=8时,ClO2被还原为____。

(5)亚氯酸根离子(ClO2-)对人体不利,欲在弱碱性条件下将水中的ClO2-转化为Cl-除去。若该反应体系中的物质有:NaClO2、Fe(OH)3、NaHCO3、FeCl2、NaCl、H2O、CO2。写出并配平有关化学方程式,并标出电子转移的方向和数目:_____。ClO2更适合用于饮用水的消毒,其原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应A+B→C(放热)分两步进行①A+B→X(吸热);②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是______。
A.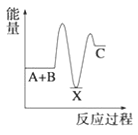 B.
B.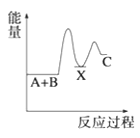
C.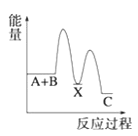 D.
D.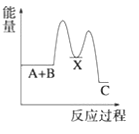
(2)①合成氨工业中,合成塔中每产生2molNH3,放出92.2kJ热量,已知(见图1):则1molN﹣H键断裂吸收的能量约等于______kJ。
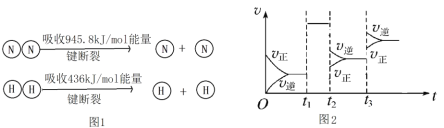
②图2t2时刻改变的条件是______,t3时刻改变的条件是______。
③某温度下,若把10molN2与30molH2置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则氮气的转化率______。
④绝热恒容条件下,可以作为判断该反应达到平衡状态的依据是_____。
A.容器内气体的总压强保持不变
B.H2、N2的反应速率比为3∶1
C.容器内气体的平均摩尔质量保持不变
D.容器内气体的温度保持不变E.容器内气体的密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com