
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 使酚酞变红色的溶液中:Na+、A13+、SO42-、Cl-
B. ![]() =10的溶液中:NH4+、Ca2+、 Cl-、NO3-
=10的溶液中:NH4+、Ca2+、 Cl-、NO3-
C. 在氯水中:Fe2+、K+、NO3-、SO42-
D. 水电离出的c(H+)=1×10-13molL-1的溶液中:K+、Na+、AlO2-、HCO3-
科目:高中化学 来源: 题型:
【题目】(Ⅰ)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL/SPT) | 50 | 120 | 232 | 290 | 310 |
(1)上述时间段中(填0~1、1~2、2~3、3~4、4~5 min)反应速率最大的是
_____________min,其主要原因是_____________。
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率__________________ 。
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是(填编号) __________ 。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
(Ⅱ)某同学做同周期元素性质递变规律实验时,自己设计了—套实验方案,并记录了有关实验现象如下表(表中的“实验方案”与“实验现象”前后不—定是对应关系)
实验方案 | 实验现象 |
①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色。 |
②钠与滴有酚酞试液的冷水反应 | B.有气体产生,产生的气体可在空气中燃烧,溶液变成浅红色。 |
③镁带与2mol/L盐酸反应 | C.反应不十分剧烈,产生的气体可以在空气中燃烧。 |
④铝条与2mol/L盐酸反应 | D.生成白色胶状沉淀,继而沉淀消失。 |
⑤向氯化铝溶液中滴加氢氧化钠溶液至过量 | E.剧烈反应,产生的气体可以在空气中燃烧。 |
请你帮助该同学整理并完成实验报告
(1)实验目的:_________________。
(2)实验用品:仪器:①砂纸,②试管,③胶头滴管,④酒精灯,⑤试管夹、试管架,⑥滤纸,⑦镊子,⑧小刀,⑨玻璃片,⑩锥形瓶(100mL)等;
药品:钠、镁条、铝条、2mol/L,的盐酸、AlCl3溶液、氢氧化钠溶液等。
(3)填写与实验方案相对应的实验现象(从上表“实验现象”中选择),并完成有关离子方程式
实验方案 | 实验现象(填写字母代号) | 有关离子方程式 |
① | _________ | Mg+2H2O(热水)==Mg(OH)2+H2↑ |
② | _________ | _____________________ |
③ | _________ | Mg+2H+==Mg2++H2↑ |
④ | _________ | ___________________ |
⑤ | _________ | Al3+ + 3OH- = Al(OH)3↓ |
___________________ |
(4)实验结论:_____________________
(5)该同学在本实验④中用去m克纯固体,反应完毕后无固体剩余,共收集到VL气体(SPT)下,该同学欲求此固体的原子量的表达式为________(用含m和V的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。某化学兴趣小组进行如下有关SO2性质和含量测定的探究活动。
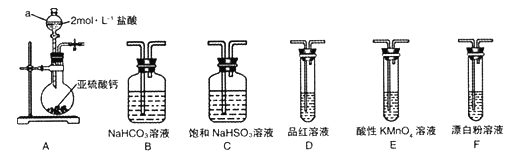
(1)装置A中仪器a的名称为__________。若利用装置A中产生的气体证明+4价的硫元素具有氧化性,试用化学方程式表示该实验方案的反应原理________________。
(2)选用图4中的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按A→C→F→尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是_________________。
②丙同学设计的合理实验方案为:按照A→C→_________→F→尾气处理(填字母) 顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是_____________________。
③其中装置C的作用是__________。常温下,测得装置C中饱和NaHSO3溶液的pH≈5,则该溶液中所有离子的浓度由大到小的顺序为__________________。(已知0.1mol/L的H2SO3溶液pH >1)
(3)为了测定装置A残液中SO2的含量,量取10.00 mL残液于圆底烧瓶中,加热使SO2 全部蒸出,用20.00 mL0.0500 mol/L的KMnO4溶液吸收。充分反应后,再用0.2000mol/L的KI标准溶液滴定过量的KMnO4 ,消耗KI溶液15.00 mL。
已知:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
10I-+2MnO4-+16H+=2Mn2++5I2+8H2O
①残液中SO2的含量为_______g·L-1。
②若滴定过程中不慎将KI标准溶液滴出锥形瓶外少许,使测定结果_______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《汉书·食货志》记载“金谓五色之金也,其黄者曰金,白者曰银,赤者曰铜,黑者曰铁……”文中所述金属能与浓盐酸反应生成氢气的是
A. 金 B. 银 C. 铜 D. 铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 符合同一通式的两种有机物一定互为同分异构体
B. 苯乙烯分子中的所有碳原子可能在同一平面上
C. 同分异构现象的存在是有机物种类繁多的原因之一
D. 乙醇和乙酸生成酯和酯的水解反应都属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键的叙述,正确的是( )
A.离子化合物中一定含有离子键
B.单质分子中均不存在化学键
C.含有极性键的分子中一定不含非极性键
D.含有共价键的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 25 ℃时部分弱电解质的电离平衡常数数据如下表:

回答下列问题:
(1)写出碳酸的主要的电离方程式 。若将碳酸饱和溶液稀释 10 倍,则稀释后的溶液中 c(H+) 原来的十分之一(填“大于”、“小于”或“等于”).
(2))物质的量浓度均为 0.1mol/L 的五种溶液:pH 由小到大的顺序为 (用编号填写)。
a.CH3COONa b. Na2CO3 c. NaClO d.NaHCO3 e.NaSCN
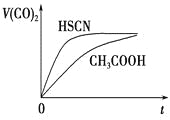
(3)25℃时,将 20mL0.1mol·L-1CH COOH 溶液和 20mL0.1mol·L-1HSCN 溶液分别与 20mL0.1mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图。反应初始阶段两种溶液产生 CO2 气体的速率存在明显差异的原因是 反应结束后,假设 NaHCO3 完全反应且气体全部逸出,则所得两溶液中,c(CH3COO-) _c(SCN-)(填“>”、“<”或“=”;)
(4)25℃时,CH3COONa 与 CH3COOH 的混合溶液,若测得 pH=8,则溶液中c(Na+)―c(CH3COO-)=_ mol/L(填代入数据后的计算式,不必算出具体数值)。
(5)向 NaClO 溶液中通入少量的 CO2,发生反应的离子方程式为 __________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气H2S经资源化利用后可回收能量并得到单质硫。反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH=-632 kJ·mol-1。H2S燃料电池的工作原理如图所示。下列有关说法不正确的是

A. 电极a为电池的负极
B. 电极b上的电极反应式为:O2+4H++4e-=2H2O
C. 若电路中通过2 mol电子,则电池内部释放632 kJ热能
D. 若有17 g H2S参与反应,则会有1 mol H+经质子膜进入正极区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com