
【题目】A、B、C、D、E、F属于短周期主族元素.A的原子半径是短周期中最大,B元素的原子最外层电子数为m、次外层电子数为n,C元素的原子L层电子数为m+n,M层电子数为m﹣n,D元素与C元素同主族,E元素原子与B元素原子的核外电子数之比为2:1,F的一种原子中,质量数与质子数之差为零.
(1)B2﹣的离子结构示意图 , DE2的电子式 .
(2)A、B形成的简单离子的半径由大到小的顺序为(用具体符号表示).
(3)A、E形成的是(填共价或离子)化合物
(4)C在周期表中的位置是
(5)由元素C形成的单质Y与由A,B,F三种元素形成的化合物X的水溶液反应的离子方程式为 .
【答案】
(1) ;
;![]()
(2)Na+<O2﹣
(3)离子
(4)第三周期第ⅣA
(5)Si+H2O+2OH﹣═SiO32﹣+2H2↑
【解析】解:由分析可知:A为Na元素;B为O元素;C为Si元素;D为C元素;E为S元素;F为H元素;
(1.)O2﹣的离子结构示意图  ,CS2的电子式类似于CO2 , 电子式为
,CS2的电子式类似于CO2 , 电子式为 ![]() ,所以答案是:
,所以答案是:  ;
; ![]() ;
;
(2.)电子层结构相同,核电荷数越多半径越小,所以Na+的半径小于O2﹣的半径,所以答案是:Na+<O2﹣;
(3.)Na、S形成的硫化钠是离子化合物,所以答案是:离子化合物;
(4.)14号元素Si,三个电子层,最外层4个电子,所以在周期表中的位置是第三周期,第ⅣA,所以答案是:第三周期第ⅣA;
(5.)元素Si形成的单质Si与由Na、O、H三种元素形成的化合物氢氧化钠的水溶液反应的离子方程式为:Si+H2O+2OH﹣═SiO32﹣+2H2↑,所以答案是:Si+H2O+2OH﹣═SiO32﹣+2H2↑.


科目:高中化学 来源: 题型:
【题目】用铂电极电解CuSO4溶液,当铜离子浓度降至一半时,停止通电,若使CuSO4溶液恢复到原浓度,应加入的物质是
A. CuO B. H2O C. CuSO4 D. Cu(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钻、钙等多种化学物质。
请回答下列问题:
(1) 区分晶体硼和无定形硼最可靠的科学方法为___________。第二周期元素的电负性按由小到大的顺序排列,B元素排在第__________位,其基态原子价层电子的电子云轮廊图为 _______________。
(2)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为____________,Si原子的杂化类型为__________________。
(3) N元素位于元素周期表_____________区;基态N原子中,核外电子占据最高能级的电子云有______伸展方向。

(4)[Co(NH3)6]3+的几何构型为正八面体形,Co在中心。
①[Co(NH3)6]3+中,1个Co提供_______________个空轨道。
②若将[Co(NH3)6]3+中的两个NH3分子换成两个Cl-,可以形成_____________种不同的结构形式。
(5)—种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。
①与Ti紧邻的Ca有___________________个。
②若Ca与O之间的最短距离为α pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g· cm-3(用含α、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG来表示溶液的酸度,其表达式为:AG=lg[![]() ]。298 K时,用0.1 mol/L的盐酸溶液滴定10 mL 0.1 mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )
]。298 K时,用0.1 mol/L的盐酸溶液滴定10 mL 0.1 mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )
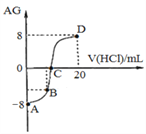
A. 该滴定实验最好选择酚酞作为指示剂
B. C点时加入盐酸溶液的体积等于10 mL
C. 滴定过程中从A点到D点,溶液中水的电离程度先逐渐减小,后逐渐增大
D. 若B点加入的盐酸溶液体积为5mL,则所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分离(括号内的物质为杂质)的方法错误的是( )
A.硝基苯(苯)--蒸馏
B.乙烯(SO2)--氢氧化钠溶液
C.己烷(己烯)--溴水,分液
D.乙酸乙酯(乙醇)--碳酸钠溶液,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溶液中分别通入足量的相应气体后,下列各组离子还能大量存在的是
A. 氯气:K+、Na+、SiO32-、NO3- B. 二氧化硫:Na+、NH4+、SO32-、Cl-
C. 氨气:K+、Na+、AlO2-、CO32- D. 二氧化氮:Na+、K+、S2O32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前正在探索的一种新型电池,现在已经使用的氢氧燃料电池的基本反应是:x 极:O2(g) + 2H2O(l) + 4e- == 4OH- y极:2H2(g) + 4OH-- 4e-== 4H2O(l) 判断下列说法中正确的是 ( )
A.x极为电池的负极 B.x极附近溶液的pH值减小
C.y极发生氧化反应 D.电流由y极流向x极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如下图所示,且每一段只对应一个反应。下列说法正确的

A. 开始时产生的气体为H2
B. AB段产生的反应为置换反应
C. 所用混合溶液中c(HNO3)=0.5mol·L-1
D. 参加反应铁粉的总质量m2=5.6 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com