
分析 (1)分清电解质的强弱,强电解质在水溶液里完全电离生成阴阳离子,电离方程式写“=”,弱电解质在水溶液里部分电离,电离方程式写“?”,书写时要遵循原子守恒、电荷守恒,据此分析解答;
(2)(a)醋酸与氢氧化钠混合反应生成醋酸钠和水;
(b)碳酸钙与盐酸反应生成氯化钙、二氧化碳和水;
(c)硫化亚铁固体(FeS)和稀硫酸反应来制取H2S气体.
解答 解:(1)(a)硫酸氢钠在水中完全电离出钠离子、氢离子、硫酸根离子,电离方程式为:NaHSO4=Na++H++SO42-,
故答案为:NaHSO4=Na++H++SO42-;
(b)氢氧化钠是强碱,为强电解质,在溶液中完全电离,电离方程式为:NaOH=Na++OH-,
故答案为:NaOH=Na++OH-;
(c)碳酸钠为强电解质,完全电离,其电离方程式为:Na2CO3=2Na++CO32-;
故答案为:Na2CO3=2Na++CO32-.
(2)(a)醋酸与氢氧化钠溶液反应生成醋酸钠和水,其离子反应为CH3COOH+OH-→CH3COO-+H2O;
故答案为:CH3COOH+OH-→CH3COO-+H2O;
(b)碳酸钙与盐酸反应生成氯化钙、二氧化碳和水,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O;
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(c)硫化亚铁固体(FeS)和稀硫酸反应来制取H2S气体,反应的离子方程式为:FeS+2H+=Fe2++H2S↑;
故答案为:FeS+2H+=Fe2++H2S↑.
点评 本题考查电离方程式和离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应书写的考查,题目难度不大.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在 0.1mol•L-1FeCl3溶液中,K+、Na+、I-、SCN- | |
| B. | 在$\frac{{c({H^+})}}{{c(O{H^-})}}={10^{12}}$的溶液中Al3+、NO3-、K+、Cl- | |
| C. | 1.0mol•L-1KMnO4溶液,H+、Fe2+、Cl-、SO42- | |
| D. | 通入大量 CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2,N2,SO2 | B. | CO2,NO2,H2S | C. | Cl2,H2,HBr | D. | O2,H2,NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
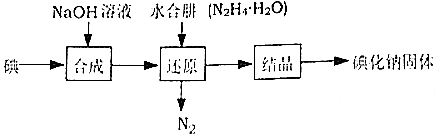
| 规定序号 | 待测体积/mL | 盛装标准滴定管的起点读数/mL | 盛装标准滴定管的终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
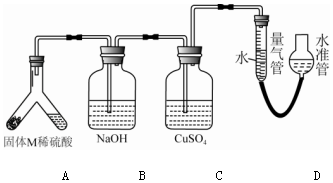
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
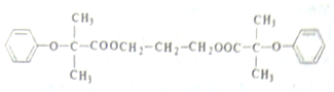

 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$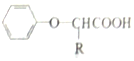
 .
.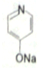 (
( 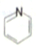 与苯环性质相似)与
与苯环性质相似)与  合成
合成  的路线:
的路线: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com