
分析 (1)金属钠可以和水以及空气中的成分:氧气、氮气、二氧化碳之间反应,据此回答;氢化钠与水反应生成氢氧化钠和氢气;
(2)含元素化合价降低的物质为氧化剂,含元素化合价升高的物质为还原剂;
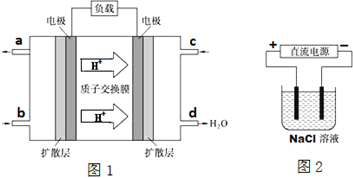
(3)①由氢离子移动方向知,右侧电极为正极,正极通入氧气,即c口通入的物质为氧气,氧气获得电子与氢离子结合生成水,左侧电极为负极,负极上通入燃料甲醇,甲醇失去电子,生成二氧化碳与氢离子;
根据n=$\frac{m}{M}$计算甲醇物质的量,再根据碳元素化合价变化计算转移电子;
②模拟氯碱工业,若只有铝棒和碳棒两个电极,铝棒作阴极、碳棒作阳极,电解氯化钠溶液生成氢氧化钠、氢气与氯气.
解答 解:(1)金属钠可以和水以及空气中的成分:氧气、氮气、二氧化碳之间反应,件数钠着火,可以用沙土扑灭,故选C;
氢化钠与水反应生成氢氧化钠和氢气,化学方程式:NaH+H2O=NaOH+H2↑;
故答案为:c; NaH+H2O=NaOH+H2↑;
(2)反应2Na2S+2O2+H2O=Na2S2O3+2NaOH中O2中O化合价降低,所以其为氧化剂,Na2S中S元素的化合价升高,为还原剂,根据得失电子守恒,该反应中氧化剂与还原剂的物质的量之比为1:1,
故答案为:1:1;
(3))①由氢离子移动方向知,右侧电极为正极,正极通入氧气,即c口通入的物质为氧气,正极电极反应式为:O2+4e-+4H+=2H2O,左侧电极为负极,负极上通入燃料甲醇,负极电极反应式为:CH3OH+H2O-6e-═CO2+6H+;
当6.4g甲醇完全反应生成CO2时,转移电子的物质的量=$\frac{6.4g}{32g/mol}$×6=1.2mol,则转移电子个数为:1.2NA,
故答案为:O2+4e-+4H+=2H2O;CH3OH+H2O-6e-═CO2+6H+;1.2NA;
②模拟氯碱工业,若只有铝棒和碳棒两个电极,铝棒作阴极,连接电源的负极,碳棒作阳极,连接电源正极,电解总反应式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:铝棒;2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
点评 本题为综合题,考查钠及其化合物性质、氧化还原反应计算、电化学,熟悉钠、氢化钠性质,明确氧化还原反应规律、原电池工作原理是解题关键,侧重对基础知识的综合应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | AlCl3过量 | |
| B. | AlCl3的量恰好与氢氧化钠完全反应 | |
| C. | 两种碱均过量 | |
| D. | AlCl3的量恰好与氨水完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 0~2 min的平均速率v(Z)=2.0×10-3 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前 v(正)<v(逆) | |
| C. | 该温度下此反应的平衡常数K=144 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$ NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| B. | Mg3N2$\stackrel{H_{2}O}{→}$Mg(OH)2$\stackrel{△}{→}$MgO | |
| C. | Mg$→_{加热}^{SO_{2}}$MgO | |
| D. | MgCl2(aq)$\stackrel{蒸发浓缩}{→}$MgCl2•6H2O$\stackrel{熔融电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但它不能解释的事实是邻二溴苯只有一种 | |
| C. | 光导纤维、棉花、油脂、ABS树脂都是由高分子化合物组成的物质 | |
| D. | 乙酸乙酯中的少量乙酸可用NaOH溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2;△H3>△H4 | B. | △H1>△H2;△H3<△H4 | C. | △H1=△H2;△H3<△H4 | D. | △H1<△H2;△H3<△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛既具有氧化性也具有还原性 | |
| B. | 煤的气化和干馏原理相同 | |
| C. | 动物油加入稀硫酸生产肥皂 | |
| D. | 石油裂解和蔗糖水解都是由高分子生成小分子的过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com